Николай Глинка - Общая химия
- Название:Общая химия
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Николай Глинка - Общая химия краткое содержание
Учебное пособие предназначено для студентов нехимических специальностей высших учебных заведений. Оно может служить пособием для лиц, самостоятельно изучающих основы химии, и для учащихся химических техникумов и старших классов средней школы.
Легендарный учебник, переведенный на многие языки стран Европы, Азии, Африки и выпущенный общим тиражом свыше 5 миллионов экземпляров.
При изготовлении файла, использован сайт http://alnam.ru/book_chem.php
Общая химия - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
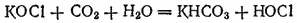
Последняя и обесцвечивает красящие вещества, окисляя их.
Аналогичный раствор, содержащий гипохлорит натрия, получается при пропускании хлора в раствор гидроксида натрия. Оба раствора можно получить электролизом растворов хлоридов калия или натрия, если дать возможность выделяющемуся хлору реагировать с образующимися при электролизе щелочами (см, стр. 549).
- 355 -
При действии хлора на сухую гашеную известь получается так называемая белильная, или хлорная, известь. Главной ее составной частью является соль CaOCl 2, образующаяся согласно уравнению:
Ca(OH) 2+ Cl 2= CaOCl 2+ H 2O
Этой соли отвечает структурная формула 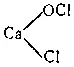 , согласно которой CaOCl 2следует рассматривать как смешанную соль соляной и хлорноватистой кислот.
, согласно которой CaOCl 2следует рассматривать как смешанную соль соляной и хлорноватистой кислот.
Хлорная известь представляет собой белый порошок с резким запахом и обладает сильными окислительными свойствами. Во влажном воздухе под действием диоксида углерода она постепенно разлагается, выделяя хлорноватистую кислоту:
2CaOCl 2+ CO 2+ H 2O = CaCO 3+ CaCl 2+2HOCl
При действии на хлорную известь соляной кислоты выделяется хлор:
CaOCl 2+ 2HCl = CaCl 2+ Cl 2+ H 2O
Хлорная известь применяется для отбелки растительного волокна (тканей, бумаги) и для дезинфекции.
В растворе хлорноватистая кислота испытывает три различных типа превращений, которые протекают независимо друг от друга:
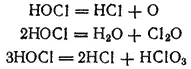
Изменяя условия, можно добиться того, что реакция пройдет практически нацело по какому-нибудь одному направлению.
Под действием прямого солнечного света и в присутствии некоторых катализаторов или восстановителей разложение хлорноватистой кислоты протекает согласно уравнению (1).
Реакция (2) идет в присутствии водоотнимающнх средств, например CaCl 2. В результате реакции получается оксид хлора(I) (хлорноватистый ангидрид) Cl 2O, представляющий собой крайне неустойчивый желто-бурый газ с запахом, похожим на запах хлора.
Распад HOCl согласно реакции (3) особенно легко идет при нагревании. Поэтому, если пропускать хлор в горячий раствор гидроксида калия, то вместо KClO сразу получается KClO 3:
3Cl 2+ 6KOH = 5KCl + KClO 3+ 3H 2O
Продуктами реакции являются хлорид калия и хлорит калия KClO 3— соль хлорноватой кислоты HClO 3. Поскольку хлорат калия (или бертолетова соль) мало растворим в холодной воде, то при охлаждении раствора он выпадает в осадок.
- 356 -
Соответствующая хлоратам хлорноватая кислота известна только в виде водного раствора с концентрацией не выше 50%. Она проявляет свойства сильной кислоты (приблизительно равной по силе HCl и HNO 3) и сильного окислителя. Так, концентрированные ее растворы воспламеняют дерево.
В противоположность свободной HClO 3, у хлоратов окислительные свойства в растворе выражены слабо. Большинство из них хорошо растворимы в воде; все они ядовиты. Наибольшее применение из хлоратов находит KClO 3, который при нагревании легко разлагается. В присутствии MnO 2(в качестве катализатора) разложение в основном протекает согласно уравнению:
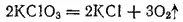
С различными горючими веществами (серой, углем, фосфором) KClO 3образует смеси, взрывающиеся при ударе. На этом основано его применение в артиллерийском деле для устройства запалов. Хлорат калия употребляется в пиротехнике для приготовления бенгальских огней и других легко воспламеняющихся смесей. Главный же потребитель хлората калия — спичечная промышленность. В головке обычной спички содержится около 50% KClO 3.
Ангидрид хлорноватой кислоты неизвестен. При действии концентрированной серной кислоты KClO 3вместо него выделяется желто-бурый газ с характерным запахом — диоксид (или двуокись) хлора ClO 2. Это очень неустойчивое соединение, которое при нагревании, ударе или соприкосновении с прочими веществами легко разлагается со взрывом на хлор и кислород.
Диоксид хлора применяют для отбелки или стерилизации различных материалов (бумажной массы, муки и др.).
При взаимодействии ClO 2с раствором щелочи медленно протекает реакция
2ClO 2+2KOH = KClO 3+KClO 2+ H 2O
с образованием солен двух кислот — хлорноватой HClO 3и хлористой HClO 2.
Хлористая кислота мало устойчива. По силе и окислительной активности она занимает промежуточное положение между HOCl и HClO 3. Соли ее - хлориты используются при отбелке тканей.
При осторожном нагревании хлората калия без катализатора его разложение протекает в основном согласно схеме:
4KClO 3= 3KClO 4+ KCl
Образующийся перхлорат калия KClO 4очень мало растворим в воде и поэтому может быть легко выделен.
Действием концентрированной серной кислоты на KClO 4может быть получена свободная хлорная кислота HClO 4, представляющая собой бесцветную, дымящую на воздухе жидкость.
Безводная HClO 4малоустойчива и иногда взрывается при хранении, но ее водные растворы вполне устойчивы. Окислительные свойства HClO 4выражены слабее, чем у HClO 3, а кислотные свойства— сильнее. Хлорная кислота — самая сильная из всех известных кислот.
- 357 -
Соли HClO 4, за немногими исключениями, к которым относится и KClO 4, хорошо растворимы и в растворе окислительных свойств не проявляют.
Если нагревать хлорную кислоту с P 2O 5, отнимающим от нее воду, то образуется оксид хлора(VII), или хлорный ангидрид, Cl 2O 7
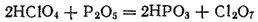
Оксид хлора(VII) - маслянистая жидкость, кипящая с разложением при 80°C. При ударе или при сильном нагревании Cl 2O 7взрывается.
Изменение свойств в ряду кислородных кислот хлора можно выразить следующей схемой:

С увеличением степени окисленности хлора устойчивость его кислородных кислот растет, а их окислительная способность уменьшается. Наиболее сильный окислитель — хлорноватистая кислота, наименее сильный — хлорная кислота.
Напротив, сила кислородных кислот хлора возрастает с увеличением его степени окисленности. Из всех гидроксидов хлора самая слабая кислота — хлорноватистая, самая сильная — хлорная. Такая закономерность — усиление кислотных свойств гидроксида (и, соответственно, ослабление его основных свойств) с ростом степени окисленности элемента характерна не только для хлора, но и для других элементов. В первом приближении эту закономерность можно объяснить, рассматривая все химические связи в молекулах гидроксидов как чисто ионные.
Читать дальшеИнтервал:
Закладка:








