Николай Глинка - Общая химия
- Название:Общая химия
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Николай Глинка - Общая химия краткое содержание
Учебное пособие предназначено для студентов нехимических специальностей высших учебных заведений. Оно может служить пособием для лиц, самостоятельно изучающих основы химии, и для учащихся химических техникумов и старших классов средней школы.
Легендарный учебник, переведенный на многие языки стран Европы, Азии, Африки и выпущенный общим тиражом свыше 5 миллионов экземпляров.
При изготовлении файла, использован сайт http://alnam.ru/book_chem.php
Общая химия - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
- 396 -
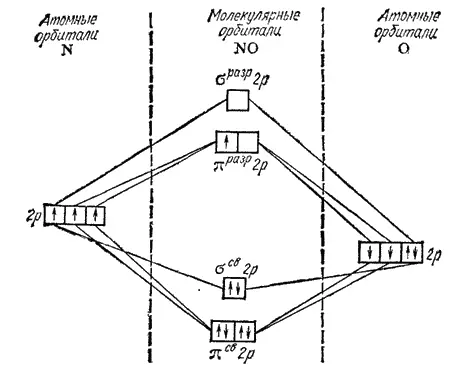
Рис. 116. Энергетическая схема образования молекулы NO.
Вместе с тем, по энергии диссоциации молекула NO близка к молекулярному иону кислорода O 2 +(644 кДж/моль), в котором кратность связи также равна 2,5 (см. стр. 142).
При отрыве от молекулы NO одного электрона образуется NO+, не содержащий разрыхляющих электронов; кратность связи между атомами возрастает при этом до трех (шесть связывающих электронов). Поэтому энергия диссоциации иона NO+ (1050 кДж/моль) выше энергии диссоциации молекулы NO и близка к соответствующей величине для молекулы СО (1076 кДж/моль), в которой кратность связи равна трем.
Диоксид (или двуокись) азота NO 2— бурый ядовитый газ, обладающий характерным запахом. Он легко сгущается в красноватую жидкость (темп. кип. 21°C), которая при охлаждении постепенно светлеет и при -11.2°C замерзает, образуя бесцветную кристаллическую массу. При нагревании газообразного диоксида азота его окраска, наоборот, усиливается, а при 140°C становится почти черной. Изменение окраски диоксида азота при повышении температуры сопровождается и изменением его молекулярной массы. При низкой температуре плотность пара приблизительно отвечает удвоенной формуле N 2O 4. С повышением температуры плотность пара уменьшается и при 140°C соответствует формуле NO 2. Бесцветные кристаллы, существующие при —11,2°C и ниже, состоят из молекул N 2O 4. По мере нагревания молекулы NO 2диссоциируют с образованием молекул темно-бурого диоксида азота; полная диссоциация происходит при 140°C.
- 397 -
Таким образом, при температурах от —11,2 до 140°C молекулы NO 2и N 2O 4находятся в равновесии друг с другом:
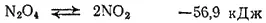
Выше 140°C начинается диссоциация NO 2на NO и кислород.
Диоксид азота — очень энергичный окислитель. Многие вещества могут гореть в атмосфере NO 2, отнимая от него кислород. Диоксид серы окисляется им в триоксид, на чем основан нитрозный метод получения серной кислоты (см. § 131).
Пары NO 2ядовиты. Вдыхание их вызывает сильное раздражение дыхательных путей и может привести к серьезному отравлению.
При растворении в воде NO 2вступает в реакцию с водой, образуя азотную и азотистую кислоты.
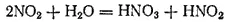
Поэтому диоксид азота можно считать смешанным ангидридом этих кислот.
Но азотистая кислота очень нестойка и быстро разлагается:
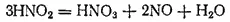
Поэтому практически взаимодействие диоксида азота с водой особенно с горячей, идет согласно уравнению
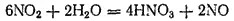
которое можно получить сложением двух предыдущих уравнений, если предварительно первое из них умножить на три.
В присутствии воздуха образующийся оксид азота немедленно окисляется в диоксид азота, так что в этом случае NO 2в конечном итоге полностью переходит в азотную кислоту:
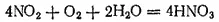
Эта реакция используется в современных способах получения азотной кислоты.
Если растворять диоксид азота в щелочах, то образуется смесь солей азотной и азотистой кислот, например:
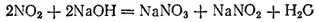
Оксид азота(III), или азотистый ангидрид, N 2O 3представляет собой темно-синюю жидкость, уже при низких температурах разлагающуюся на NO и NO 2. Смесь равных объемов NO и NO 2при охлаждении вновь образует N 2O 3:
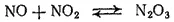
Оксиду азота(III) соответствует азотистая кислота HNO 2.
Оксид азота (V), или азотный ангидрид, N 2O 5белые кристаллы, уже при комнатной температуре постепенно разлагающиеся на NO 2и O 2.
- 398 -
Он может быть получен действием фосфорного ангидрида на азотную кислоту:
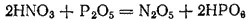
Оксид азота(V) — очень сильный окислитель. Многие органические вещества при соприкосновении с ним воспламеняются. В воде оксид азота(V) хорошо растворяется с образованием азотной кислоты.
В твердом состоянии N 2O 5образован нитратным ионом NO 3 -и ионом нитрония NO 2 +. Последний содержит такое же число электронов, что и молекула CO 2и, подобно последней, имеет линейное строение: O=N +=O. В парах молекула N 2O 5симметрична; ее строение может быть представлено следующей валентной схемой, в которой пунктиром показаны трехцентровые связи (ср. с валентной схемой молекулы азотной кислоты на стр. 134):
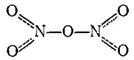
141. Азотистая кислота.
Если нагревать нитрат калия или натрия, то они теряют часть кислорода и переходят в соли азотистой кислоты HNO 2. Разложение идет легче в присутствии свинца, связывающего выделяющийся кислород:
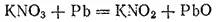
Соли азотистой кислоты — нитриты — образуют кристаллы, хорошо растворимые в воде (за исключением нитрита серебра). Нитрит натрия NaNO 2применяется при производстве различных красителей.
При действии на раствор какого-нибудь нитрита разбавленной серной кислотой получается свободная азотистая кислота:
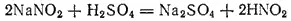
Она принадлежит к числу слабых кислот (K = 4·10 -4) и известна только в сильно разбавленных водных растворах. При концентрировании раствора или при его нагревании азотистая кислота распадается:
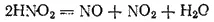
Степень окисленности азота в азотистой кислоте равна +3, т. е. является промежуточной между низшими и высшей из возможных значений степени окисленности азота. Поэтому HNO 2проявляет окислительно-восстановительную двойственность. Под действием восстановителей она восстанавливается (обычно до NO), а в реакциях с окислителями — окисляется до HNO 3. Примерами могут служить следующие реакции:
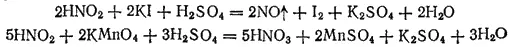
Интервал:
Закладка:








