Николай Глинка - Общая химия
- Название:Общая химия
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Николай Глинка - Общая химия краткое содержание
Учебное пособие предназначено для студентов нехимических специальностей высших учебных заведений. Оно может служить пособием для лиц, самостоятельно изучающих основы химии, и для учащихся химических техникумов и старших классов средней школы.
Легендарный учебник, переведенный на многие языки стран Европы, Азии, Африки и выпущенный общим тиражом свыше 5 миллионов экземпляров.
При изготовлении файла, использован сайт http://alnam.ru/book_chem.php
Общая химия - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
Чтобы понять происходящую реакцию, представим фосфат кальция как соединение оксида кальция с фосфорным ангидридом (3CaO·P 2O 5); песок же состоит в основном из диоксида кремния SiO 2. При высокой температуре диоксид кремния вытесняет фосфорный ангидрид и, соединяясь с оксидом кальция, образует легкоплавкий силикат кальция CaSiO 3, а фосфорный ангидрид восстанавливается углем до свободного фосфора:
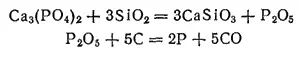
Складывая оба уравнения, получаем:
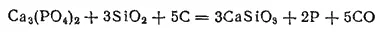
Фосфор выделяется в виде паров, которые конденсируются в приемнике под водой.
Фосфор образует несколько аллотропических видоизменений.
Белый фосфор получается в твердом состоянии при быстром охлаждении паров фосфора; его плотность 1,83 г/см 3. В чистом виде белый фосфор совершенно бесцветен и прозрачен; продажный продукт обычно окрашен в желтоватый цвет и по внешнему виду похож на воск. На холоду белый фосфор хрупок, но при температуре выше 15°C становится мягким и легко режется ножом.
На воздухе белый фосфор очень быстро окисляется и при этом светится в темноте. Отсюда произошло название «фосфор», которое в переводе с греческого означает «светоносный». Уже при слабом нагревании, для чего достаточно простого трения, фосфор воспалменятеся и сгорает, выделяя большое количество теплоты. Фосфор может и самовоспламениться на воздухе вследствие выделения теплоты при окислении.
- 405 -
Чтобы защитить белый фосфор от окисления, его сохраняют под водой. В воде белый фосфор нерастворим; хорошо растворяется в сероуглероде.
Белый фосфор имеет молекулярную кристаллическую решетку, в узлах которой находятся тетраэдрические молекулы P 4. Прочность связи между атомами в этих молекулах сравнительно невелика. Это объясняет высокую химическую активность белого фосфора.
Белый фосфор — сильный яд, даже в малых дозах действующий смертельно.
Если белый фосфор долго нагревать без доступа воздуха при 250-300°C, то он превращается в другое видоизменение фосфора, имеющее красно-фиолетовый цвет и называемое красным фосфором. Такое же превращение происходит, но только очень медленно, под действием света.
Красный фосфор по своим свойствам резко отличается от белого: он очень медленно окисляется на воздухе, не светится в темноте, загорается только при 260°C, не растворяется в сероуглероде и неядовит. Плотность красного фосфора составляет 2.0-2.4 г/см 3. Переменное значение плотности обусловлено тем, что красный фосфор состоит из нескольких форм. Их структура не вполне выяснена, однако известно, что они являются полимерными веществами.
При сильном нагревании красный фосфор, не плавясь, испаряется (сублимируется). При охлаждении паров получается белый фосфор.
Черный фосфор образуется из белого при нагревании его до 200-220°C под очень высоким давлением. По виду он похож на графит, жирен на ощупь и тяжелее других видоизменений; его плотность равна 2.7 г/см 3. Черный фосфор — полупроводник.
Применение фосфора весьма разнообразно. Большое количество его расходуется на производство спичек.
При изготовлении спичек применяется красный фосфор; он содержится в массе, которая наносится на спичечную коробку. Головка же спички состоит из смеси горючих веществ с бертолетовой солью и соединениями, катализирующими распад соли MnO 2, Fe 2O 3и др.)
Кроме спичечного производства, фосфор применяется в металлургии. Он используется для получения некоторых полупроводников— фосфида галлия GaP, фосфида индия InP. В состав других полупроводников он вводится в очень небольших количествах в качестве необходимой добавки. Кроме того, он входит в состав некоторых металлических материалов, например оловянистых бронз.
При горении фосфора образуется густой белый дым; поэтому белым фосфором снаряжают боеприпасы (артиллерийские снаряды, авиабомбы и др.), предназначенные для образования дымовых завес.
- 406 -
Большое количество фосфора идет на производство фосфорорганических препаратов, к числу которых относятся весьма эффективные средстве уничтожения насекомых-вредителей.
Свободный фосфор чрезвычайно активен. Он непосредственно взаимодействует со многими простыми веществами с выделением большого количества теплоты. Легче всего фосфор соединяется с кислородом, затем с галогенами, серой и со многими металлами, причем в последнем случае образуются фосфиды, аналогичные нитридам, — например Ca 3P 2, Mg 3P 2и др. Все эти свойства особенно резко проявляются у белого фосфора; красный фосфор реагирует менее энергично, черный вообще с трудом вступает в химические взаимодействия.
146. Соединения фосфора с водородом и галогенами.
С водородом фосфор образует газообразный фосфористый водород, или фосфин, PH 3. Его можно получить кипячением белого фосфора с раствором щелочи или действием соляной кислоты на фосфид кальция Ca 3P 2:
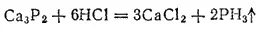
Фосфин — бесцветный газ с чесночным запахом, очень ядовитый. При его горении образуются фосфорный ангидрид и вода:
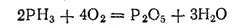
Основные свойства выражены у фосфина слабее, чем у аммиака. Он образует соли только с наиболее сильными кислотами, например PClO 4, HCl. В этих солях катионом является ион фосфония PH 4 +. Примером может служить хлорид фосфония PH 4Cl. Соли фосфония — очень непрочные соединения; при взаимодействии с водой они разлагаются на галогеноводород и фосфин.
Фосфор непосредственно соединяется со всеми галогенами с выделением большого количества теплоты. Практическое значение имеют главным образом соединения фосфора с хлором.
Хлорид фосфора(III), или треххлористый фосфор, PCl 3получается при пропускании хлора над расплавленным фосфором. Он представляет собой жидкость, кипящую при 75°C.
При действии воды PCl 3полностью гидролизуется с образованием хлороводорода и фосфористой кислоты H 3PO 3:
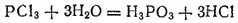
При пропускании хлора в треххлористый фосфор получается хлорид фосфора(V), или пятихлористый фосфор, PCl 5, который при обычных условиях образует твердую белую массу. Пятихлористый фосфор тоже разлагается водой с образованием хлороводорода и фосфорной кислоты. Аналогичные соединения фосфор образует с бромом, иодом и фтором; однако для иода соединение состава PI 5неизвестно.
Читать дальшеИнтервал:
Закладка:








