Николай Глинка - Общая химия
- Название:Общая химия
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Николай Глинка - Общая химия краткое содержание
Учебное пособие предназначено для студентов нехимических специальностей высших учебных заведений. Оно может служить пособием для лиц, самостоятельно изучающих основы химии, и для учащихся химических техникумов и старших классов средней школы.
Легендарный учебник, переведенный на многие языки стран Европы, Азии, Африки и выпущенный общим тиражом свыше 5 миллионов экземпляров.
При изготовлении файла, использован сайт http://alnam.ru/book_chem.php
Общая химия - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
Гидрокарбонат кальция — вещество непрочное. При кипячении раствора или продолжительном его стоянии на воздухе гидрокарбонат разлагается с выделением CO 2и образованием средней соли.
Растворимостью гндрокарбонатов в воде объясняется постоянное передвижение карбонатов в природе. Почвенные и грунтовые воды, содержащие CO 2, просачиваясь сквозь почву и особенно сквозь пласты известняка, растворяют карбонат кальция и уносят его с собой в виде гидрокарбоната в ручьи, реки и моря. Оттуда он попадает в организмы морских животных и идет на построение их скелетов или, выделяя диоксид углерода, снова превращается в карбонат кальция и отлагается в виде пластов.
Кроме карбоната кальция, в природе встречается в больших количествах карбонат магния MgCO 3, известный под названием магнезита. Карбонат магния, как и карбонат кальция, легко растворяется в воде, содержащей CO 2, переходя в растворимый гидрокарбонат.
Некоторые карбонаты являются ценными рудами и служат для получения металлов (например, шпатовый железняк FeCO 3, галмей ZnCO 3).
Карбонат натрия, или сода, Na 2CO 3. В виде кристаллогидрата сода отвечает формуле Na 2CO 3·H 2O. Однако этот кристаллогидрат легко выветривается — теряет часть кристаллизационной воды.
Сода — один из главных продуктов основной химической промышленности. Она в больших количествах потребляется стекольной, мыловаренной, целлюлозно-бумажной, текстильной, нефтяной и другими отраслями промышленности, а также служит для получения различных солей натрия. Применяется сода и в быту, главным образом как моющее средство.
В настоящее время соду получают в промышленности аммиачно-хлоридным способом, основанным на образовании гидрокарбоната натрия при реакции между хлоридом натрия и гидрокарбонатом аммония в водном растворе.
Концентрированный раствор хлорида натрия насыщают аммиаком, а затем пропускают в него под давлением диоксид углерода, получаемый обжигом известняка.
При взаимодействии аммиака, диоксида углерода и воды образуется гидрокарбонат аммония
NH 3+ CO 2+ H 2O = NH 4HCO 3
который, вступая в обменную реакцию с хлоридом натрия, образует хлорид аммония и гидрокарбонат натрия:
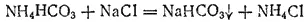
Гидрокарбонат натрия сравнительно мало растворим в холодной воде и выделяется в виде осадка, который отфильтровывают.
При прокаливании гидрокарбонат натрия разлагается на карбонат, воду и диоксид углерода, вновь поступающий в производство:
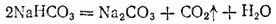
Нагревая раствор, содержащий хлорид аммония, с гашеной известью, выделяют аммиак
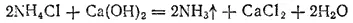
который также возвращается в производство.
Таким образом, единственным отходом производства является хлорид кальция, остающийся в растворе после выделения аммиака и имеющий ограниченное применение.
Полученный по аммначно-хлоридному способу карбонат натрия не содержит кристаллизационой воды и называется кальцинированной содой.
Часть гидрокарбоната натрия используется без дальнейшей переработки. Например, под названием питьевой, или двууглекислой, соды он применяется в медицине, в хлебопечении, в пищевой промышленности.
Производство кальцинированной соды в СССР непрерывно растет. В 1957 г. оно составило 1.6 млн. т, примерно втрое превысив объем производства 1940 г., а в 1985 г. достигло 503 млн. т.
Карбонат калия, или поташ, K 2CO 3представляет собой белый порошок, расплывающийся во влажном воздухе и хорошо растворимый в воде. Применяется он для получения мыла, при изготовлении тугоплавкого стекла, в фотографии. Поташ получают действием диоксида углерода на раствор гидроксида калия, образующийся при электролизе раствора хлорида калия:
2KOH + CO 2= K 2CO 3+ H 2O
Важное в практическом отношении соединение — карбамид, или мочевина, CO(NH 2) 2получается взаимодействием диоксида углерода с аммиаком под давлением:
CO 2+ 2NH 3= CO(NH 2) 2+ H 2O
Этот способ получения карбамида был открыт в 1870 г., А. И. Базаровым.
- 428 -
Карбамид представляет собой белые кристаллы, хорошо растворимые в воде. Он используется в сельском хозяйстве в качестве высококонцентрированного азотного удобрения и как добавка к корму жвачных животных. На основе карбамида получают дешевые пластические массы, так называемые карбамидные пластики. Он служит также исходным материалом для получения многих органических веществ и лекарственных препаратов. Некоторые производные карбамида обладают гербицидными свойствами — они применяются для борьбы с сорняками.
156. Оксид углерода (II).
Оксид углерода(II), или монооксид углерода, СО — бесцветный ядовитый газ, конденсирующийся в жидкость только при -192°C и затвердевающий при -205°C. В воде оксид углерода растворим очень мало и не вступает с ней в химическое взаимодействие.
Электронное строение молекулы СО рассмотрено на стр. 143. Как показано на рис. 53, шесть валентных электронов атомов углерода и кислорода размещаются на трех связывающих МО, образуя тройную связь; эта связь характеризуется высокой прочностью (1076 кДж/моль).
Образование тройной связи в молекуле СО можно объяснить и методом ВС. За счет двух неспаренных электронов, имеющихся в каждом из взаимодействующих атомов

возникают две ковалентные связи:
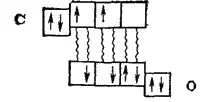
Как показывает эта схема, одна из орбиталей внешнего электронного слоя атома углерода остается незанятой электронами, так что этот атом может быть акцептором электронной пары. Атом же кислорода сохраняет на одной из р-орбиталей неподеленную электронную пару и обладает, следовательно, электроно-донорными свойствами. В результате образуется еще одна ковалентная связь — донорно-акцепторная:
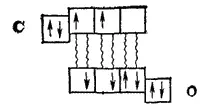
В образовавшейся таким образом молекуле каждый из атомов имеет во внешнем слое восемь электронов. Структуру молекулы СО можно изобразить схемой:
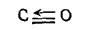
- 429 -
Здесь стрелкой показана связь, образованная по донорно-акцепторному способу.
Читать дальшеИнтервал:
Закладка:








