Николай Глинка - Общая химия
- Название:Общая химия
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Николай Глинка - Общая химия краткое содержание
Учебное пособие предназначено для студентов нехимических специальностей высших учебных заведений. Оно может служить пособием для лиц, самостоятельно изучающих основы химии, и для учащихся химических техникумов и старших классов средней школы.
Легендарный учебник, переведенный на многие языки стран Европы, Азии, Африки и выпущенный общим тиражом свыше 5 миллионов экземпляров.
При изготовлении файла, использован сайт http://alnam.ru/book_chem.php
Общая химия - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
2. Исключительным свойством углерода, обусловливающим многообразие органических соединений, является способность его атомов соединяться прочными ковалентными связями друг с другом, образуя углеродные цепи практически неограниченной длины
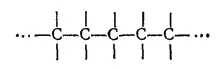
Валентности атомов углерода, не пошедшие на взаимное соединение, используются для присоединения других атомов или групп (в углеводородах — для присоединения водорода).
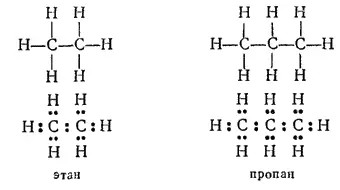
Так, углеводороды этан (C 2H 6) и пропан (C 3H 8) содержат цепи соответственно из двух и трех атомов углерода.
- 441 -
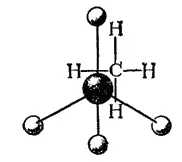
Рис. 122. Шариковая модель молекулы метана.
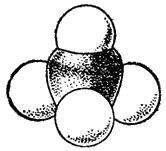
Рис. 123. Сегментовая модель молекулы метана.
Строение их выражают следующие структурные и электронные формулы:
Известны соединения, содержащие в цепях сотни и более атомов углерода.
Наращивание углеродной цепи на один атом углерода ведет к увеличению состава на группу CH 2. Такое количественное изменение состава приводит к новому соединению, обладающему несколько иными свойствами, т. е. уже качественно отличающемуся от исходного соединения; однако общий характер соединений сохраняется. Так, кроме углеводородов метана (CH 4), этана (C 2H 6), пропана (C 3H 8) существуют бутан (C 4H 10), пентан (C 5H 12) и т. д. Таким образом, в огромном многообразии органических веществ могут быть выделены ряды однотипных соединений, в которых каждый последующий член отличается от предыдущего на группу CH 2. Такие ряды называют гомологическими рядами, их члены по отношению друг к другу являются гомологами, а существование таких рядов называется явлением гомологии.
Следовательно, углеводороды метан, этап, пропан, бутан и т. д. — гомологи одного и того же ряда, который называют рядом предельных, или насыщенных, углеводородов (алканов) или, по первому представителю, - рядом метана.
Вследствие тетраэдрической направленности связей углерода, его атомы, входящие в цепь, располагаются не на прямой, а зигзагообразно, причем, благодаря возможности вращения атомов вокруг оси связи, цепь в пространстве может принимать различные формы (конформации):
- 442 -
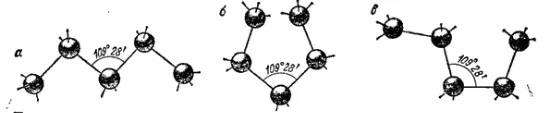
Такая структура цепей дает возможность сближаться концевым (б) или другим не смежным атомам углерода (в); в результате возникновения связи между этими атомами углеродные цепи могут замыкаться в кольца (циклы), например:
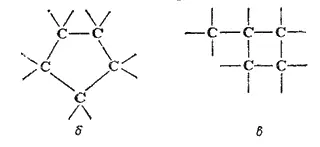
Таким образом, многообразие органических соединений определяется и тем, что при одинаковом числе атомов углерода в молекуле возможны соединения с открытой, незамкнутой цепью углеродных атомов, а также вещества, молекулы которых содержат циклы (циклические соединения).
3. Ковалентные связи между атомами углерода, образованные одной парой обобщенных электронов, называют простыми (или ординарными) связями.
Связь между атомами углерода может осуществляться не одной, а двумя или тремя общими парами электронов. Тогда получаются цепи с кратными — двойными или тройными связями; эти связи можно изобразить следующим образом:

Простейшие соединения, содержащие кратные связи, - углеводороды этилен (с двойной связью) и ацетилен (с тройной связью):
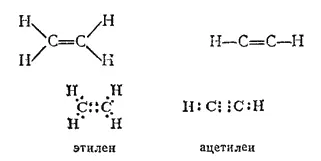
Углеводороды с кратными связями называются непредельными или ненасыщенными. Этилен и ацетилен — первые представители двух гомологических рядов — этиленовых и ацетиленовых углеводородов.
- 443 -
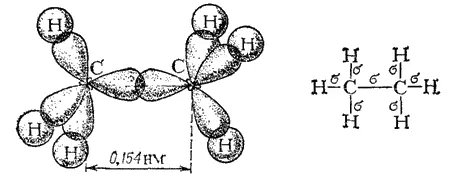
Рис. 124. Схема образования σ-связей в молекуле этана.
Простая ковалентная связь C-C (или С:С), образованная перекрыванием двух sp 3-гибридных электронных облаков по линии, соединяющей центры атомов (по оси связи), как, например, в этане (рис. 124), представляет собой σ-связь (см. § 42). Связи C-H также являются σ-связями — они образуются перекрыванием по оси связи sp 3-гибридного облака атома С и шарового облака 1s-электрона атома Н.
Природа кратных углерод-углеродных связей несколько иная. Так, в молекуле этилена при образовании двойной ковалентной связи C=C (или C::C) в каждом из атомов углерода в гибридизации участвует одна s-орбиталь и только две р-орбнтали (sp 2-гибридизация); одна из р-орбиталей каждого атома С не гибридизуется. В результате образуются три sp 2-гибридных электронных облака, которые участвуют в образовании трех σ-связей. Всего в молекуле этилена пять σ-связей (четыре C-H и одна C-C); все они расположены в одной плоскости под углами около 120° друг к другу (рис. 125).
Таким образом, одна из электронных пар в связи C=C осуществляет σ-связь, а вторая — образуется р-электронами, не участвующими в гибридизации; их облака сохраняют форму объемной восьмерки ("гантели"), ориентированы перпендикулярно к плоскости, в которой расположены σ-связи, и перекрываются над и под этой плоскостью (рис. 126), образуя π-связь (см. § 42).
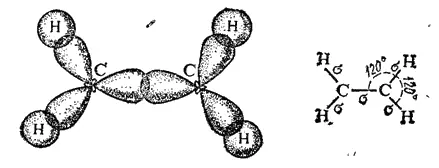
Рис. 125. Схема образования σ-связей в молекуле этилена.
- 444 -
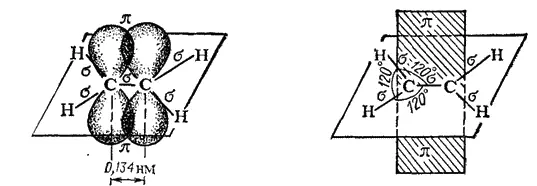
Рис. 126. Схема образования π-связи в молекуле этилена.
Следовательно, двойная связь С = С представляет собой сочетание одной σ и одной π-связей.
Тройная связь ≡ (или ⁝⁝) является сочетанием одной σ-связи и двух π-связей. Например, при образовании молекулы ацетилена в каждом из атомов углерода в гибридизации участвует одна s-орбиталь и только одна р-орбиталь (sp-гибридизация); в результате образуются два sp-гибридных электронных облака, участвующих в образовании двух σ-связей. Облака двух р-электронов каждого атома С не гибридизуются, сохраняют свою конфигурацию и участвуют в образовании двух π-связей. Таким образом, в ацетилене всего три σ-связи (одна C-C и две C-H), направленные вдоль одной прямой, и две π-связи, ориентированные в двух взаимно перпендикулярных плоскостях (рис. 127).
Читать дальшеИнтервал:
Закладка:








