Николай Глинка - Общая химия
- Название:Общая химия
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Николай Глинка - Общая химия краткое содержание
Учебное пособие предназначено для студентов нехимических специальностей высших учебных заведений. Оно может служить пособием для лиц, самостоятельно изучающих основы химии, и для учащихся химических техникумов и старших классов средней школы.
Легендарный учебник, переведенный на многие языки стран Европы, Азии, Африки и выпущенный общим тиражом свыше 5 миллионов экземпляров.
При изготовлении файла, использован сайт http://alnam.ru/book_chem.php
Общая химия - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
- 504 -
На основе кремнийорганические смол получают каучукоподобные материалы, сохраняющие свою эластичность при температурах от —60 до +200°C и не разрушающиеся даже при 300°C.
Кремнийорганические соединения применяются для придания несмачиваемости стеклу, бумаге, ткани, строительным материалам.
186. Германий (Germanium).
Этот элемент, существование которого было в 1871 г. предсказано Д. И. Менделеевым на основе периодического закона, открыт в 1886 г. немецким химиком Винклером (см. § 19). Общее содержание германия в земной коре составляет около 0,0007% (масс.). Минералы, содержащие германий в сколько-нибудь значительных количествах, крайне редки. Источником получения германия обычно служат побочные продукты, получающиеся при переработке руд цветных металлов, а также зола от сжигания некоторых углей.
В компактном состоянии германий имеет серебристый цвет и по внешнему виду похож на металл. При комнатной температуре он устойчив к действию воздуха, кислорода, воды, соляной и разбавленной серной кислот. Азотная и концентрированная серная кислоты окисляют его до диоксида GeO 2, особенно при нагревании
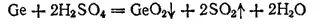
Германий взаимодействует также со щелочами в присутствии пероксида водорода. При этом образуются соли германиевой кислоты — германаты, например:
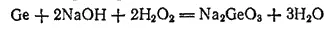
Соединения германия(II) малоустойчивы. Гораздо более характерны для германия соединения, в которых степень его окисленности равна +4.
Диоксид германия GeO 2— белые кристаллы плотностью 4,703 г/см 3, заметно растворимые в воде, причем раствор проводит электрический ток. Получают GeO 2различными способами; в частности, он может быть получен нагреванием германия в кислороде или окислением его концентрированной азотной кислотой.
Диоксид германия — амфотерное соединение с сильно преобладающими кислотными свойствами, вследствие чего он легко растворяется в щелочах, образуя германаты.
Германоводороды. Действуя на хлорид германия GeCl 4амальгамой иатрия в токе водорода или же разлагая кислотами сплав германия с магнием, можно получить тетрагидрид германия GeH 4. Это бесцветный газ, который аналогично гидриду мышьяка при нагревании разлагается, образуя на стенках реакционного сосуда металлическое зеркало.
При получении простейшего германоводорода - образуются в небольшом количестве его гомологи Ge 2H 6и Ge 3H 8.
Германий обладает полупроводниковыми свойствами и с этим связано его основное применение. Германий, идущий для изготовления полупроводниковых приборов, подвергается очень тщательной очистке.
- 505 -
Она осуществляется различными способами. Один из важнейших методов получения высокочистого германия — это зонная плавка (см. § 193). Для придания очищенному германию необходимых электрических свойств в него вводят очень небольшие количества определенных примесей. Такими примесями служат элементы пятой и третьей групп периодической системы, например, мышьяк, сурьма, алюминий, галлий. Полупроводниковые приборы из германия (выпрямители, усилители) широко применяются в радио- и телевизионной технике, в радиолокации, в счетно-решающих устройствах. Из германия изготовляют также термометры сопротивления.
Из соединений германия применяют, например, GeO 2, который входит в состав стекол, обладающих высоким коэффициентом преломления и прозрачностью в инфракрасной части спектра.
187. Олово (Stannuin).
Олово не принадлежит к числу широко распространенных металлов (содержание его в земной коре составляет 0,04 %), но оно легко выплавляется из руд и поэтому стало известно человеку в виде его сплавов с медью (бронзы) со времен глубокой древности. Олово обычно встречается в виде кислородного соединения SnO 2оловянного камня, из которого и получается посредством восстановления углем.
В свободном состоянии олово — серебристо-белый мягкий металл. При сгибании палочки олова слышится характерный треск, обусловленный трением отдельных кристаллов друг о друга. Олово обладает мягкостью и тягучестью и легко может быть прокатано в тонкие листы, называемые оловянной фольгой или станиолем.
Кроме обычного белого олова, кристаллизующегося в тетрагональной системе, существует другое видоизменение олова — серое олово, кристаллизующееся в кубической системе и имеющее меньшую плотность. Белое олово устойчиво при температурах выше 14°C, а серое — при температурах ниже 14°C. Поэтому при охлаждении белое олово превращается в серое. В связи со значительным изменением плотности металл при этом рассыпается в серый порошок. Это явление получило название оловянной чумы. Быстрее всего превращение белого олова в серое протекает при температурах около -30°C; оно ускоряется в присутствии зародышей кристаллов серого олова.
Сплавы олова с сурьмой и медью применяются для изготовления подшипников. Эти сплавы (оловянные баббиты) обладают высокими антифрикционными свойствами. Сплавы олова со свинцом — припои — широко применяются для пайки. В качестве легирующего компонента олово входит в некоторые сплавы меди.
На воздухе олово при комнатной температуре не окисляется, но нагретое выше температуры плавления постепенно превращается в диоксид олова SnO 2.
Вода не действует на олово.
- 506 -
Разбавленные соляная и серная кислоты действуют на него очень медленно, что объясняется большим перенапряжением выделения водорода на этом металле. Концентрированные растворы этих кислот, особенно при нагревании, растворяют олово. При этом в соляной кислоте получается хлорид олова (II), а в серной — сульфат олова (IV);
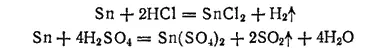
С азотной кислотой олово взаимодействует тем интенсивнее, чем выше концентрация кислоты и температура. В разбавленной кислоте образуется растворимый нитрат олова (II)
4Sn + 10HNO 3= 4Sn(NO 3) 2+ NH 4NO 3+ 3H 2O
а в концентрированной — соединения олова (IV), главным образом нерастворимая β-оловянная кислота, состав которой приблизительно соответствует формуле H 2SnO 3:
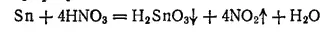
Концентрированные щелочи также растворяют олово. В этом случае получаются станниты — соли оловянистой кислоты H 2SnO 2:
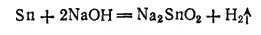
Интервал:
Закладка:








