Николай Глинка - Общая химия
- Название:Общая химия
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Николай Глинка - Общая химия краткое содержание
Учебное пособие предназначено для студентов нехимических специальностей высших учебных заведений. Оно может служить пособием для лиц, самостоятельно изучающих основы химии, и для учащихся химических техникумов и старших классов средней школы.
Легендарный учебник, переведенный на многие языки стран Европы, Азии, Африки и выпущенный общим тиражом свыше 5 миллионов экземпляров.
При изготовлении файла, использован сайт http://alnam.ru/book_chem.php
Общая химия - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
В растворах станниты существуют в гидратированных формах, образуя гидроксостанниты, например:
Na 2SnO 2+ 2H 2O = Na 2[Sn(OH) 4]
На воздухе олово покрывается тонкой оксидной пленкой, обладающей защитным действием. Поэтому в условиях несильного коррозионного воздействия оно является химически стойким металлом. Около 40% всего выплавляемого олова расходуется для покрытия им изделий из железа, соприкасающихся с продуктами питания, Прежде всего — консервных банок. Это объясняется указанной химической стойкостью олова, а также тем, что оно легко наносится на железо и что продукты его коррозии безвредны.
Олово образует устойчивые соединения, в которых имеет степень окисленности +2 и +4.
Оксид олова(II) , или окись олова, SnO — темно-бурый порошок, образующийся при разложении гидроксида олова (II) Sn(OH) 2в атмосфере диоксида углерода.
Гидроксид олова (II) Sn(OH) 2получается в виде белого осадка при действии щелочей на соли олова (II):
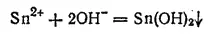
Гидроксид олова (II) — амфотерное соединение. Он легко растворяется как в кислотах, так и в щелочах, в последнем случай с образованием гидроксостаннитов:
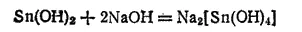
- 507 -
Хлорид олова(II) SnCl 2·2H 2O образует бесцветные кристаллы. При нагревании или сильном разбавлении хлорида(II) водой происходит его частичный гидролиз с образованней осадка основной соли:
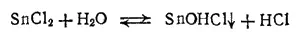
Хлорид олова (II) — восстановитель. Так, хлорид железа (III) FeCl 3восстанавливается им в хлорид железа (II) FeCl 2:
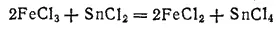
При действии хлорида олова (II) на раствор хлорида ртути (II) (сулемы) HgCl 2образуется белый осадок хлорида ртути (I) (каломели) Hg 2Cl 2:
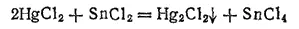
При избытке хлорида олова восстановление идет еще дальше и получается металлическая ртуть:
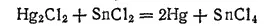
Диоксид (или двуокись) олова SnO 2встречается в природе и может быть получен искусственно сжиганием металла на воздухе или окислением его азотной кислотой с последующим прокаливанием полученного продукта. Применяется диоксид олова для приготовления белых глазурей и эмалей.
Гидроксиды олова (IV) называются оловянными кислотами и известны в двух модификациях: в виде α-оловянной кислоты и в виде β-оловянной кислоты.
α-Оловянная кислота H 2SnO 2может быть получена действием водного раствора аммиака на раствор хлорида олова(IV):
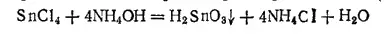
Выпадающий белый осадок при высушивании постепенно теряет воду, превращаясь в диоксид олова. Таким образом кислоты определенного состава получить не удается. Поэтому приведенная выше формула α-оловянной кислоты является лишь простейшей из возможных. Правильнее было бы изобразить состав этой кислоты формулой mSnO 2·nH 2O.
α-Оловянная кислота легко растворяется в щелочах, образуя соли, содержащие комплексный анкон [Sn(OH) 6] 2-и называемые гидроксостаннатами:
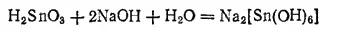
Гидроксостаннат натрия выделяется из растворов в виде кристаллов, состав которых можно выразить формулой Na 2SnO 3·3H 2O. Эта соль применяется в качестве протравы в красильном деле и для утяжеления шелка. Шелковые ткани, обработанные перед Крашением растворами соединений олова, иногда содержат, до 50%(масс.) олова.
- 508 -
Кислоты также растворяют α-оловянную кислоту с образованием солей олова (IV). Например:
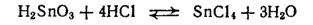
При избытке соляной кислоты хлорид олова(IV) присоединяет две молекулы хлороводорода, образуя комплексную гексахлоро-оловянную (или оловянохлористоводородную) кислоту H 2[SnCl 6]. Аммонийная соль этой кислоты (NH 4) 2[SnCl 6] имеет то же применение, что и гидроксостаннат натрия.
β-Оловянная кислота получается в виде белого порошка при действии концентрированной азотной кислоты на олово (см. выше). Состав ее столь же неопределенен, как и состав α-оловянной кислоты. В отличие от α-оловянной кислоты, она не растворяется ни в кислотах, ни в растворах щелочей. Но путем сплавления со щелочами можно перевести ее в раствор в виде станната. α-Оловянная кислота при хранении ее в соприкосновении с раствором, из которого она выделилась, постепенно тоже превращается в β-оловянную кислоту.
Хлорид олова(IV) представляет собой жидкость, кипящую при 112°C и сильно дымящую на воздухе. Хлорид олова (IV) образуется при действии хлора на металлическое олово или на хлорид олова (II). В технике его получают главным образом путем обработки отбросов белой жести (старых консервных банок) хлором.
Хлорид олова (IV) растворяется в воде и может быть выделен из раствора в виде различных кристаллогидратов, например SnCl 4·5H 2O.
В водных растворах, особенно в разбавленных, хлорид олова (IV) подвергается гидролизу; конечным продуктом гидролиза является α-оловянная кислота:

Гидрид олова SnH 4-бесцветный, очень ядовитый газ. Он сжижается при -52°C, а при комнатной температуре постепенно разлагается на олово и водород.
Сульфиды олова. При действии сероводорода на раствор хлорида олова(II) получается бурый осадок сульфида олова(II). Из раствора хлорида олова (IV) при тех же условиях выпадает желтый осадок дисульфида олова SnS 2. Последнее соединение может быть получено также нагреванием оловянных опилок с серой и хлоридом аммония. Приготовленный по этому способу дисульфид имеет вид золотисто-желтых чешуек и под названием «сусального золота» употребляется для позолоты дерева.
Дисульфид олова растворяется в растворах сульфидов щелочных металлов и аммония, причем получаются легкорастворимые соли тиооловянной кислоты H 2SnS 3:
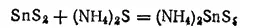
Интервал:
Закладка:








