Николай Глинка - Общая химия
- Название:Общая химия
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Николай Глинка - Общая химия краткое содержание
Учебное пособие предназначено для студентов нехимических специальностей высших учебных заведений. Оно может служить пособием для лиц, самостоятельно изучающих основы химии, и для учащихся химических техникумов и старших классов средней школы.
Легендарный учебник, переведенный на многие языки стран Европы, Азии, Африки и выпущенный общим тиражом свыше 5 миллионов экземпляров.
При изготовлении файла, использован сайт http://alnam.ru/book_chem.php
Общая химия - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
При нагревании колебания атомов металла около их равновесных положений в кристаллической решетке становятся более интенсивными, что затрудняет движение электронов. Поэтому с повышением температуры электрическое сопротивление металлов возрастает.
Рассмотренная картина электронного строения твердых металлов показывает, что валентные электроны, осуществляющие химическую связь, принадлежат не двум или нескольким определенным атомам, а всему кристаллу металла. При этом валентные электроны способны свободно перемещаться в объеме кристалла. Образованную подобным образом химическую связь называют металлической связью, а совокупность «свободных» электронов в металле — электронным газом. Металлическая связь характерна для металлов, их сплавов и интерметаллических соединений (см. стр. 534).
Пластичность металлов также объясняется специфическими свойствами металлической связи. При механическом воздействии на твердое тело отдельные слои его кристаллической решетки вращаются относительно друг друга. В кристаллах с атомной структурой это приводит к разрыву ковалентных связей между атомами, принадлежащими различным слоям, и кристалл разрушается. В кристаллах с ионной структурой при взаимном смещении слоев неизбежно создается такое положение, при котором рядом оказываются одноименно заряженные ионы; при этом возникают силы электростатического отталкивания и кристалл также разрушается. В случае же металла при смещении отдельных слоев его кристаллической решетки происходит лишь некоторое перераспределение электронного газа, связывающего друг с другом атомы металла, но разрыва химических связей не происходит — металл деформируется, не разрушаясь.
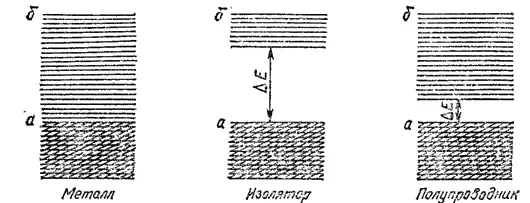
Рис. 138. Схема расположения энергетических зон в металле, изоляторе и полупроводнике: а — валентная зона; б — зона проводимости.
В отличие от металлов кристаллы простых веществ, образованных неметаллами, обычно не обладают заметной электронной проводимостью (см. табл. 29); они представляют собою изоляторы (диэлектрики). Хотя в этом случае тоже возможно образование непрерывных энергетических зон, но здесь зона проводимости отделена от валентной зоны запрещенной зоной, т. е. значительным энергетическим промежутком ΔE (рис. 138, изолятор). Энергия теплового движения или слабого электрического поля оказывается недостаточной для преодоления этого промежутка, и электроны не переходят из валентной зоны в зону проводимости. Таким образом, в изоляторах электроны не могут свободно перемещаться по кристаллу и служить переносчиками электрического тока.
Особыми свойствами, отличающими их как от металлов, так и от изоляторов, обладают полупроводники. При низких температурах их электрическое сопротивление весьма велико и в этих условиях они проявляют свойства изоляторов. Однако при нагревании или при освещении электрическая проводимость полупроводников резко возрастает и может достигать величин, сравнимых с проводимостью металлов.
Зависимость электрических свойств полупроводников от температуры и освещенности объясняется электронным строением их кристаллов. Здесь, как и у изоляторов, валентная зона отделена от зоны проводимости запрещенной зоной (рис. 138, полупроводник). Однако ширина запрещенной зоны ΔE в случае полупроводников невелика. Поэтому при действии квантов лучистой энергии или при нагревании электроны, занимающие верхние уровни валентной зоны, могут переходить в зону проводимости и участвовать в переносе электрического тока. С повышением температуры или при увеличении освещенности число электронов, переходящих в зону проводимости, возрастает; в соответствии с этим увеличивается и электрическая проводимость полупроводника.
При переходе электронов в зону проводимости в валентной зоне возникают не полностью занятые электронами энергетические уровни — электронные вакансии, или «дырки».
- 519 -
В электрическом поле такие дырки ведут себя как положительные электрические заряды. Поэтому перенос тока в полупроводниках может осуществляться как электронами зоны проводимости (от латинского «negative» — отрицательный), так и дырками валентной зоны (р-проводимость, от латинского «positive» — положительный).
191. Кристаллическое строение металлов.
Кристаллическое строение металлов изучается различными методами. Их можно разделить на две группы. К первой принадлежат методы изучения внутреннего строения крксталлоз, ко второй — методы изучения их внешних форм.
Внутреннее строение кристаллов изучается глазным образом с помощью рентгеноструктурного анализа (см. § 50). По его данным для всех металлов установлены типы и параметры кристаллических решеток.
Кристаллические решетки металлов могут быть различных типов. Однако для большинства металлов характерны три типа решеток: объемноцентрированная кубическая (Li, Na, K, V, Cr, Fe*, Pb, W и др.), гранецентрированиая кубическая (Al, Ca, Fe**, Ni, Cu, Ag, Au и др.), гексагональная (Be, Mg, Cd, Ti, Co, Zn и др.). На рис. 139 показаны элементарные ячейки (см. § 50) решеток этих типов.
Размеры, форму и взаимное расположение кристаллов в металлах изучают металлографическими методами. Наиболее полную оценку структуры металла в этом отношении дает микроскопический анализ его шлифа. Из испытуемого металла вырезают образец и его плоскость шлифуют, полируют и протравливают специальным раствором (травителем). В результате травления выявляется структура образца, которую рассматривают или фотографируют с помощью металлографического микроскопа.
Кристаллы металлов обычно имеют небольшие размеры. Поэтому любое металлическое изделие состоит из большого числа кристаллов.
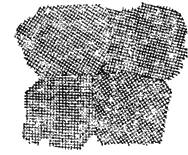
Рис. 139. Основные типы кристаллических решеток металлов: а - объемоцентрированная кубическая; б -трансцентрированная кубическая; в - гексагональная.
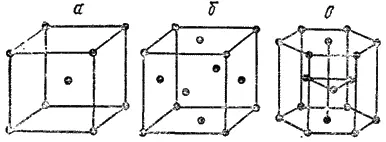
Рис. 140. Схема различной ориентации кристалических решеток в поликристаллическом теле.
* При температурах до 911 и от 1392°C до плавления
** При температурах от 911 до 1392°C
- 520 -
Такая структура называется поликристалической. При кристаллизации металла из расплавленного состояния растущие кристаллы мешают друг другу принять правильную форму. Поэтому кристаллы поликристаллического тела имеют неправильную форму и в отличие от правильно ограненных кристаллов называются кристаллитами или зернам и. Зерна различаются между собой пространственной ориентацией их кристаллических решеток (рис. 140).
Читать дальшеИнтервал:
Закладка:








