Николай Глинка - Общая химия
- Название:Общая химия
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Николай Глинка - Общая химия краткое содержание
Учебное пособие предназначено для студентов нехимических специальностей высших учебных заведений. Оно может служить пособием для лиц, самостоятельно изучающих основы химии, и для учащихся химических техникумов и старших классов средней школы.
Легендарный учебник, переведенный на многие языки стран Европы, Азии, Африки и выпущенный общим тиражом свыше 5 миллионов экземпляров.
При изготовлении файла, использован сайт http://alnam.ru/book_chem.php
Общая химия - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
Суммарное содержание этих солей в воде называется ее общей жесткостью. Она подразделяется на карбонатную и некарбонатную жесткость.
- 597 -
Первая из них обусловлена присутствием гидрокарбонатов кальция и магния, вторая — присутствием солей сильных кислот — сульфатов или хлоридов кальция и магния. При длительном кипячении воды, обладающей карбонатной жесткостью, в ней появляется осадок, состоящий главным образом из CaCO 3, и одновременно выделяется CO 2. Оба эти вещества появляются вследствие разложения гпдрокарбоната кальция:
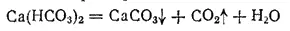
Поэтому карбонатную жесткость называют также временной жесткостью. Количественно временную жесткость характеризуют содержанием гидрокарбонатов, удаляющихся из воды при ее кипячении в течение часа. Жесткость, остающаяся после такого кипячения, называется постоянной жесткостью.
В СССР жесткость воды выражают суммой миллиэквивалентов ионов кальция и магния, содержащихся в 1 л воды. Один миллиэквивалент жесткости отвечает содержанию 20,04 мг/л Ca 2+или 12,16 мг/л Mg 2+.
Жесткость природных вод изменяется в широких пределах. Она различна в разных водоемах, а в одной и той же реке изменяется в течение года (минимальна во время паводка). В табл. 33 приведены величины жесткости воды некоторых рек СССР в летний период.
Таблица 33. Жесткость воды некоторых рек СССР
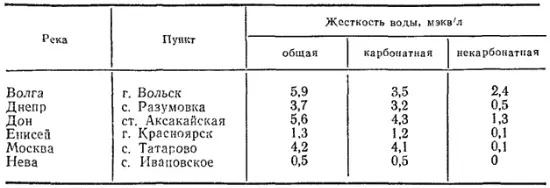
Жесткость вод морей значительно выше, чем рек и озер. Так, вода Черного моря имеет общую жесткость 65,5 мэкв/л. Среднее значение жесткости воды мирового океана 130,5 мэкв/л (в том числе на Ca 2+приходится 22,5 мэкв/л, на Mg 2+- 108 мэкв/л).
Присутствие в воде значительного количества солей кальция или магния делает воду непригодной для многих технических целей. Так, при продолжительном питании паровых котлов жесткой водой их стенки постепенно покрываются плотной коркой накипи. Такая корка уже при толщине слоя в 1 мм сильно понижает передачу теплоты стенками котла и, следовательно, ведет к увеличению расхода топлива. Кроме того, она может служить причиной образования вздутий и трещин как в кипятильных трубах, так и на стенках самого котла.
- 598 -
Жесткая вода не дает пены с мылом, так как содержащиеся в мыле растворимые натриевые соли жирных кислот —пальмитиновой и стеариновой — переходят в нерастворимые кальциевые соли тех же кислот:

Жесткой водой нельзя пользоваться при проведении некоторых технологических процессов, например при крашении.
Приведенные выше примеры указывают на необходимость удаления из воды, применяемой для технических целей, солей кальция и магния. Удаление этих солей, называемое водоумягчением, входит в систему водоподготовки — обработки природной воды, используемой для питания паровых котлов и для различных технологических процессов.
В ходе водоподготовки вода освобождается от грубодисперсных и коллоидных примесей и от растворенных веществ. Взвешенные и коллоидные примеси удаляют коагуляцией их добавляемыми к воде солями (обычно Al 2(SO 4) 3) с последующей фильтрацией.
Для водоумягчения применяют методы осаждения и ионного обмена. Путем осаждения катионы Ca 2+и Mg 2+переводят в малорастворимые соединения, выпадающие в осадок. Это достигается либо кипячением воды, либо химическим путем — введением в воду соответствующих реагентов. При кипячении гидрокарбонаты кальция и магния превращаются в CaCO 3и Mg(OH) 2
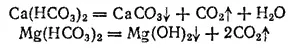
в результате чего устраняется только карбонатная жесткость.
При химическом методе осаждения чаще всего в качестве осадителя пользуются известью или содой. При этом в осадок (также в виде CaCO 3и Mg(OH) 2) переводятся все соли кальция и магния.
Для устранения жесткости методом ионного обмена (см. § 110) или катионирования воду пропускают через слой катионита. При этом катионы Ca 2+и Mg 2+, находящиеся в воде, обмениваются на катионы Na+, содержащиеся в применяемом катионите. В некоторых случаях требуется удалить из воды не только катионы Ca 2+и Mg 2+, но и другие катионы и анионы. В таких случаях воду пропускают последовательно через катионит, содержащий в обменной форме водородные ионы (Н-катионит), и анионит, содержащий гидроксид-ионы (ОН-анионит). В итоге вода освобождается как от катионов, так и от анионов солей. Такая обработка воды называется ее обессоливанием.
Когда процесс ионного обмена доходит до равновесия, ионит перестает работать — утрачивает способность умягчать воду. Однако любой ионит легко подвергается регенерации. Для этого через катионит пропускают концентрированный раствор NaCl(Na 2SO 4) или HCl(H 2SO 4).
- 599 -
При этом ионы Ca 2+и Mg 2+выходят в раствор, а катионит вновь насыщается ионами Na+ или H+. Для регенерации анионита его обрабатывают раствором щелочи или соды (последний, вследствие гидролиза карбонатного иона, также имеет щелочную реакцию). В результате поглощенные анионы вытесняются в раствор, а анионит вновь насыщается ионами OH-.
213. Стронций (Strontium). Барий (Barium).
Стронций и барий встречаются в природе главным образом в виде сульфатов и карбонатов, образуя минералы целестин SrSO 4, стронцианит SrCO 3, барит BaSO 4и витерит BaCI 3. Содержание стронция и бария в земной коре соответственно равно 0,04 и 0,05% (масс.), т. е. значительно меньше, чем содержание кальция.
Металлические стронций и барий очень активны, быстро окисляются на воздухе, довольно энергично взаимодействуют с водой (особенно барий) и непосредственно соединяются со многими элементами.
Оксиды стронция и бария SrO и BaO сходны с оксидом кальция. Оба металла образуют также пероксиды. Пероксид бария BaO 2получается при нагревании оксида бария на воздухе примерно до 500°C. При высокой температуре она снова разлагается на оксид и кислород. Пероксид бария, как и пероксид натрия, используют для беления различных материалов.
Гидроксиды стронция и бария Sr(OH) 2и Ba(OH) 2представляют собой сильные основания, лучше растворимые в воде, чем гидроксид кальция: один литр воды при 20°C растворяет 8 г гидроксида стронция и 38 г гидроксида бария. Насыщенный раствор гидроксида бария называется баритовой водой и часто применяется в качестве реактива.
Соли стронция и бария имеют сходство с солями кальция. Карбонаты и сульфаты SrCO 3, BaCO 3, SrSO 4и BaSO 4обладают очень малой растворимостью в воде и выпадают из раствора в виде осадков, если ионы стронция и бария встречаются с ионами CO 3 2-или SO 4 2-. Этим пользуются при анализе для отделения стронция и бария от других металлов.
Читать дальшеИнтервал:
Закладка:








