Николай Глинка - Общая химия
- Название:Общая химия
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Николай Глинка - Общая химия краткое содержание
Учебное пособие предназначено для студентов нехимических специальностей высших учебных заведений. Оно может служить пособием для лиц, самостоятельно изучающих основы химии, и для учащихся химических техникумов и старших классов средней школы.
Легендарный учебник, переведенный на многие языки стран Европы, Азии, Африки и выпущенный общим тиражом свыше 5 миллионов экземпляров.
При изготовлении файла, использован сайт http://alnam.ru/book_chem.php
Общая химия - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
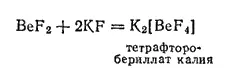
Здесь атом бериллия находится в состоянии sp 3-гибридизации, благодаря чему ион BeF 4 2-построен в форме тетраэдра. Тетраэдрическое расположение атомов бериллия и кислорода характерно и для кристаллического оксида бериллия. В водных растворах ион бериллия, по-видимому, находится также в виде тетраэдрических аквакомплексов [Be(H 2O) 4] 2+.
Оксид бериллия BeO — белое, очень тугоплавкое вещество. Применяется в качестве химически устойчивого огнеупорного материала (в реактивных двигателях, для изготовления тиглей, в электротехнике) и как конструкционный материал в ядерных реакторах.
Гидроксид бериллия Be(OH) 2имеет ясно выраженный амфотерный характер, чем резко отличается от гидроксидов щелочноземельных металлов.
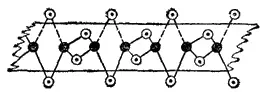
Рис. 163. Схема строения линейного полимера (BeCl 2) n: черные кружки - атомы алюминия, светлые — атомы хлора.
- 592 -
В воде он практически нерастворим, но легко растворяется как в кислотах, так и в щелочах, в последнем случае с образованием гидроксоберпллатов:
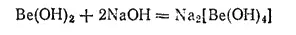
Кислотные свойства гидроксида бериллия выражены очень слабо, поэтому в водном растворе бериллаты сильно гидролизуются.
Большинство солей бериллия, в том числе и сульфат, хорошо растворимы в воде, тогда как сульфаты щелочноземельных металлов в воде практически нерастворимы. В водных растворах ионы Be 2+подвергаются гидролизу, благодаря чему растворы солей бериллия имеют кислую реакцию.
Все соединения бериллия токсичны. В частности, весьма опасно пребывание в атмосфере, содержащей пыль бериллия или его соединений.
210. Магний (Magnesium).
Магний весьма распространен в природе. В больших количествах он встречается в виде карбоната магния, образуя минералы магнезит MgCO 3и доломит MgCO 3·CaCO 3. Сульфат и хлорид магния входят в состав калийных минералов — каинита KCl·MgSO 4·3H 2O и карналлита KCl·MgCl 2·6H 2O. Ион Mg 2+содержится в морской воде, сообщая ей горький вкус. Общее количество магния в земной коре составляет около 2% (масс.).
Магний получают главным образом электролитическим методом. Электролизу подвергают расплавы хлорида магния или обезвоженного карналлита.
Магний — серебристо-белый, очень легкий металл. На воздухе он мало изменяется, так как быстро покрывается тонким слоем оксида, защищающим его от дальнейшего окисления.
Хотя магний стоит в ряду напряжений далеко впереди водорода, но, как мы уже говорили, воду он разлагает очень медленно вследствие образования малорастворимого гидроксида магния. В кислотах магний легко растворяется с выделением водорода. Щелочи на магний не действуют. При нагревании на воздухе магний сгорает, образуя оксид магния MgO и небольшое количество нитрида магния Mg 3N 2.
Главная область применения металлического магния — это получение на его основе различных легких сплавов. Прибавка к магнию небольших количеств других металлов резко изменяет его механические свойства, сообщая сплаву значительную твердость, прочность и сопротивляемость коррозии. Особенно ценными свойствами обладают сплавы, называемые электронами. Они относятся к трем системам: Mg-Al-Zn, Mg-Mn и Mg—Zn—Zr. Наиболее широкое применение имеют сплавы системы Mg-Al-Zn, содержащие от 3 до 10% Al и от 0,2 до 3% Zn. Достоинством магниевых сплавов является их малая плотность (около 1,8 г/см 3). Они используются прежде всего в ракетной технике и в авиастроении, а также в авто-, мото-, приборостроении.
- 593 -
Недостаток сплавов магния — их низкая стойкость против коррозии во влажной атмосфере и в воде, особенно морской.
Чистый магний находит применение в металлургии. Магнийтермическим методом получают некоторые металлы, в частности титан. При производстве некоторых сталей и сплавов цветных металлов магний используется для удаления из них кислорода и серы. Весьма широко применяется магний в промышленности органического синтеза. С его помощью получают многочисленные вещества, принадлежащие к различным классам органических соединений, а также элементорганнческие соединения. Смеси порошка магния с окислителями употребляются при изготовлении осветительных и зажигательных ракет.
Оксид магния MgO обычно получают путем прокаливания природного магнезита MgCO 3. Он представляет собой белый рыхлый порошок, известный под названием жженой магнезии. Благодаря высокой температуре плавления (около 3000°C) оксид магния применяется для приготовления огнеупорных тиглей, труб, кирпичей.
Гидроксид магния Mg(OH) 2получается в виде малорастворимого белого осадка при действии щелочей на растворимые соли магния. В отличие от гидроксида бериллия гидроксид магния обладает только основными свойствами, представляя собой основание средней силы.
Сульфат магния MgSO 4·7H 2O , или горькая соль, содержится в морской воде. В отличие от сульфатов щелочноземельных металлов, хорошо растворим в воде.
Хлорид магния MgCl 2·6H 2O. Образует бесцветные, хорошо растворимые, расплывающиеся на воздухе кристаллы. Гигроскопичность неочищенной поваренной соли обусловливается примесью к ней незначительных количеств хлорида магния.
Карбонат магния MgCO 3Встречается в природе в виде минерала магнезита.
При действии соды на растворимые соли магния получается не средняя соль, а смесь основных карбонатов. Эта смесь применяется в медицине под названием белой магнезии.
Важное промышленное значение имеет хлорид гидроксомагния MgOHCl. Технический продукт получается путем замешивания оксида магния с концентрированным водным раствором хлорида магния и носит название магнезиального цемента. Такая смесь через некоторое время затвердевает, превращаясь в плотную белую, легко полирующуюся массу. Затвердевание можно объяснить тем, что основная соль, первоначально образующаяся согласно уравнению
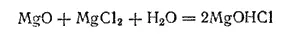
затем полимеризуется в цепи типа -Mg-O-Mg-O-Mg-, на концах которых находятся атомы хлора или гидроксильные группы.
- 594 -
Магнезиальный цемент в качестве вяжущего материала применяется при изготовлении мельничных жерновов, точильных камней, различных плит. Смесь его с древесными опилками под названием ксилолита используют для покрытия полов.
Большое применение находят природные силикаты магния: тальк 3MgO·4SiO 2·H 2O и особенно асбест CaO·3MgO·4SiO 2. Последний, благодаря своей огнестойкости, малой теплопроводности и волокнистой структуре, является прекрасным теплоизоляционным материалом.
Читать дальшеИнтервал:
Закладка:








