Николай Глинка - Общая химия
- Название:Общая химия
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Николай Глинка - Общая химия краткое содержание
Учебное пособие предназначено для студентов нехимических специальностей высших учебных заведений. Оно может служить пособием для лиц, самостоятельно изучающих основы химии, и для учащихся химических техникумов и старших классов средней школы.
Легендарный учебник, переведенный на многие языки стран Европы, Азии, Африки и выпущенный общим тиражом свыше 5 миллионов экземпляров.
При изготовлении файла, использован сайт http://alnam.ru/book_chem.php
Общая химия - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
Это уравнение выражает процесс гидролиза иона меди. Таким образом, гидролиз катионов в водных растворах можно рассматривать как кислотную диссоциацию воды в аквакомилексах.
Если в комплексном соединении одновременно содержатся протонодонорная молекула лиганда (например, H 2O, NH 3) и молекула того же лиганда, отщепившая протон и способная, следовательно, к его присоединению (например, OH -, NH 2 -), то такое комплексное соединение будет амфотерным. Так, комплекс [Pt(NH 3) 5NH 2] 3+в реакции со щелочью ведет себя как кислота, а в реакции с кислотой — как основание:
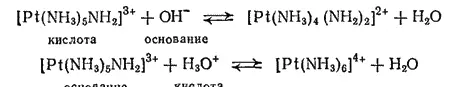
Соединение, содержащее только депротонированные ионы (OH -, NH 2 -, NH 2O -и тп.), является уже только основанием.
Основные положения теории кислотно-основных свойств комплексных соединений были разработаны А. А. Гринбергом.
Центральный ион также меняет свои свойства в результате комплексообразования, что можно видеть, например, по изменению соответствующего электродного потенциала. Так, стандартный электродный потенциал ε° системы Fe 3+/Fe 2+в водном растворе равен +0.771 B. Если же взять цианидные комплексы, содержащие железо в степени окисленности +2 и +3, то для системы [Fe(CN) 6] 3-/[Fe(CN) 6] 4-ε°=+0.36 B, из чего следует, что эта система обладает более слабыми окислительными свойствами, чем система Fe 2+/Fe 3+. В данном, наиболее типичном случае переход от гидратированных ионов к более устойчивым комплексам сопровождается преимущественной стабилизацией комплексного иона, содержащего центральный атом в высшей степени окисленности, вследствие чего окислительная способность этого иона ослабляется.
- 586 -
Кроме влияния комплексообразования на свойства лигандов и центрального атома, существует и взаимное влияние лигандов в комплексах. Наиболее ярким его проявлением является транс-влияние, открытое И. И. Черняевым. Суть этого явления заключается в том, что в комплексах, для которых возможны цис- и транс-изомеры, взаимное влияние лигандов наиболее сильно проявляется при их размещении в транс-положении по отношению друг к другу.
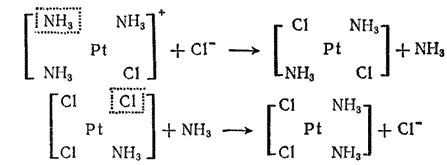
Некоторые лиганды (их называют транс-активными) ослабляют воздействие центрального атома иона свойства лиганда, находящегося в транс-положении по отношению к рассматриваемому лиганду, и приближают их к свойствам свободного лиганда. Примером проявления транс-влияния может служить получение изомерных диамминов платины(II). При нагревании тетраамминов платины(II) с концентрированной HCl обычно получаются транс-изомеры, а при действии аммиака на K 2[PtCl 4] — цис-изомеры:

Это объясняется большим транс-влиянием иона Cl- по сравнению с молекулой NH 3что и определяет наиболее лабильный лиганд (обведен) в промежуточно образующихся комплексах:
Кинетические характеристики реакций замещения также служат основанием для оценки транс-влияния лигандов. Лиганды, по их способности ускорять процесс замещения транс-расположенного лиганда, располагаются в ряд CN -, C 2H 4, CO>NO 2 -, I -, SCN ->Br ->Cl ->OH ->NH 3> H 2O.
транс-Влияние установлено в основном при изучении комплексов Pt(II), но оно проявляется и в комплексах с центральными ионами Pt(IV), Co(III), Au(III), Pd(II), Rh(I). транс-Влияние является электронным эффектом и связано с изменением электронной плотности. Одна из первых и наиболее наглядных попыток его объяснения была сделана на основе поляризационных представлении: лиганды с большим трансвлиянием имеют легко деформируемую электронную оболочку и являются хорошими восстановителями (А. А. Гринберг, Б. В. Некрасов).
- 587 -
В дальнейшем оказалось, что необходимо также учитывать и способность лиганда к л-акцепторному взаимодействию с центральным атомом.
А. А. Гринбергом и его школой было обнаружено, что кроме транс-влияния имеет место и цис-влияние лигандов, хотя этот вид взаимного влияния лигандов обычно проявляется в более слабой форме. Изменение свойств центрального атома и лигандов при комплексообразовании, а также существование транс- и цис-влияния лигандов полностью согласуется с теорией химического строения А. М. Бутлерова, учитывающей все виды взаимного влияния атома и групп атомов в молекулах (см. §§ 38 и 162),
Глава XIX. ВТОРАЯ ГРУППА ПЕРИОДИЧЕСКОЙ СИСТЕМЫ
В главную подгруппу II группы входят элементы бериллий, магний, кальций, стронций, барий и радий. Все эти элементы, кроме бериллия, обладают ярко выраженными металлическими свойствами. В свободном состоянии они представляют собой серебристо-белые вещества, более твердые, чем щелочные металлы, с довольно высокими температурами плавления. По плотности все они, кроме радия, относятся к легким металлам. Их важнейшие свойства приведены в табл. 32.
Первые два члена рассматриваемой подгруппы занимают в ней несколько особое положение, отличаясь во многих отношениях от остальных четырех элементов. Бериллий по некоторым своим свойствам приближается к алюминию («диагональное сходство» — см. стр. 590).
Все изотопы последнего элемента подгруппы — радия — радиоактивны. Долгоживущий изотоп 226Ra раньше использовался в радиотерапии; в настоящее время его заменили более дешевыми изотопами других элементов, образующимися в ядерных реакторах.
В наружном электронном слое атомы элементов этой подгруппы имеют два электрона, во втором снаружи слое у бериллия находится два электрона, а у остальных элементов — восемь. Два электрона внешнего слоя сравнительно легко отщепляются от атомов, которые превращаются при этом в положительные двухзарядные ионы. Поэтому в отношении химической активности эти элементы лишь немного уступают щелочным металлам. Подобно последним, они довольно быстро окисляются на воздухе и могут вытеснять водород из воды при комнатной температуре. Однако бериллий и магний взаимодействуют с водой очень медленно, так как образующиеся при этом гидроксиды малорастворимы в воде: покрывая поверхность металла, они затрудняют дальнейшее течение реакции. Остальные четыре металла ввиду лучшей растворимости их гидроксидов реагируют с водой значительно энергичнее.
- 588 -
Таблица 32, Некоторые свойства бериллия, магния, радия и щелочноземельных металлов
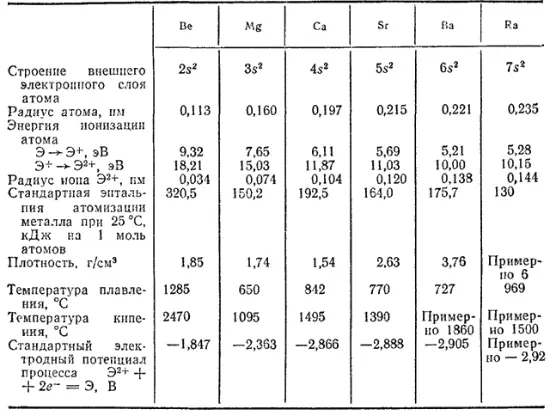
Входящие в состав главной подгруппы кальций, стронций и барий издавна получили название щелочноземельных металлов. Происхождение этого названия связано с тем, что гидроксиды кальция, стронция и бария, так же, как и гидроксиды натрия и калия, обладают щелочными свойствами, оксиды же этих металлов по их тугоплавкости сходны с оксидами алюминия и тяжелых металлов, носившими прежде общее название земель.
Читать дальшеИнтервал:
Закладка:








