Николай Глинка - Общая химия
- Название:Общая химия
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Николай Глинка - Общая химия краткое содержание
Учебное пособие предназначено для студентов нехимических специальностей высших учебных заведений. Оно может служить пособием для лиц, самостоятельно изучающих основы химии, и для учащихся химических техникумов и старших классов средней школы.
Легендарный учебник, переведенный на многие языки стран Европы, Азии, Африки и выпущенный общим тиражом свыше 5 миллионов экземпляров.
При изготовлении файла, использован сайт http://alnam.ru/book_chem.php
Общая химия - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
Разница в энергиях уровней d γи d ε, называемая энергией расщепления, обозначается буквой Δ; ее можно экспериментально определить по спектрам поглощения комплексных соединений.
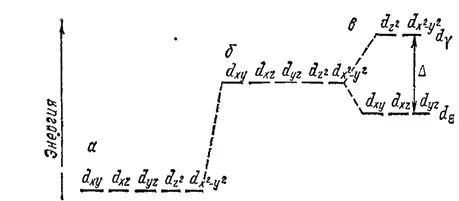
Рис. 160. Схема энергетических уровней d-орбиталей центрального иона: а — свободный ион; б — ион в гипотетическом сферическом поле; в — ион в октаэдрическом поле лигандов.
- 577 -
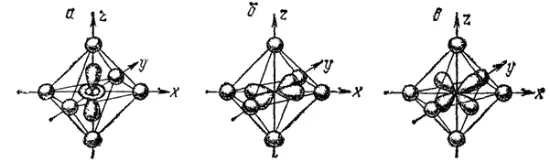
Рис. 161. Орбитали d z 2(а) и d x 2-y 2(б) и d xy(в) в октаэдрическом поле лигандоз (лиганды условно изображены в виде шариков).
Значение Δ зависит как от природы центрального атома, так и от природы лигандов: лиганды, создающие сильное поле, вызывают большее расщепление энергетических уровней, т. е. более высокое значение Δ.
По величине энергии расщепления лиганды располагаются в следующем порядке (так называемый спектрохимический ряд):
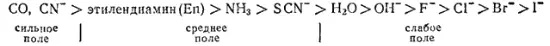
В начале этого ряда находятся лиганды, создающие наиболее сильное поле, в конце — создающие слабое поле.
Электроны центрального иона распределяются по d-орбиталям так, чтобы образовалась система с минимальной энергией. Это может быть достигнуто двумя способами: размещением электронов на d ε-орбиталях, отвечающих более низкой энергии, или равномерным распределением их по всем d-орбиталям, в соответствии с правилом Хунда (см. § 32). Если общее число электронов, находящихся на d-орбиталях центрального иона, не превышает трех, то они размещаются на орбиталях более низкого энергетического уровня d εпо правилу Хунда. Так, у иона Cr 3+, имеющего электронную конфигурацию внешнего слоя 3d 3, каждый из трех d-электронов занимает одну из трех d ε-орбиталей.
Иное положение складывается, когда на d-орбиталях центрального иона находится большее число электронов. Размещение их в соответствии с правилом Хунда требует затраты энергии для перевода некоторых электронов на d γ-орбитали. С другой стороны, при размещении максимального числа электронов на d ε-орбиталях нарушается правило Хунда и, следовательно, необходима затрата энергии для перевода некоторых электронов на орбитали, на которых уже имеется по одному электрону.
- 578 -
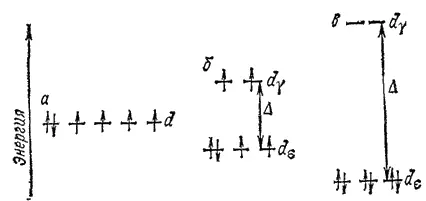
Рис. 162. распределение электронов иона Co 3+по d-орбиталям: а — в гипотетическом сферическом поле; б — в слабом октаэдрическом поле лигандов (комплекс [CoF 6] 3-); в - в сильном октаэдрическом поле лигандов (комплекс [Co(CN) 6] 3-).
- 578 -
Поэтому в случае слабого поля, т. е. небольшой величины энергии расщепления, энергетически более выгодным оказывается равномерное распределение d-электронов по всем d-орбиталям (в соответствии с правилом Хунда); при этом центральный ион сохраняет высокое значение спина, так что образуется высокоспиновый парамагнитный комплекс. В случае же сильного поля (высокое значение энергии расщепления) энергетически более выгодным будет размещение максимального числа электронов на d ε-орбиталях; при этом создается низкоспиновый диамагнитный комплекс.
С этой точки зрения понятно, почему, например, комплекс [CoF 6] 3-парамагнитен, а комплекс [Co(CN) 6] 3-диамагнитен. Положение лигандов F- и CN- в спектрохимическом ряду (см. выше) показывает, что ионам CN- соответствует значительно более высокая энергия расщепления Δ, чем ионам F-. Поэтому в рассматриваемых комплексах электроны центрального иона Co 3+распределяются по d-орбиталям так, как это показано на рис. 162: комплекс [CoF 6] 3-— высокоспиновый, а комплекс [Co(CN) 6] 3-низкоспиновый.
Мы рассмотрели теорию кристаллического поля в приложении к комплексам с октаэдрическим расположением (октаэдрической координацией) лигандов. С аналогичных позиций могут быть рассмотрены и свойства комплексов с иной, например тетраэдрической, координацией.
На основе теории кристаллического поля удается объяснить не только магнитные свойства комплексных соединений, но и их специфическую окраску. Так, в комплексе [Ti(H 2O) 6] 3+имеет один Ti 3+-электрон (электронная конфигурация d 1). В нормальном (невозбужденном) состоянии этот электрон находится на одной из d ε-орбиталей, но при затрате некоторой энергии ( Δ = 238 кДж/моль ) может возбуждаться и переходить на d γ-орбиталь. Длина волны света, поглощаемого при этом переходе и соответствующего указанной энергии, равна 500 нм: это и обусловливает фиолетовую окраску комплекса [Ti(H 2O) 6] 3+. При таком рассмотрении становится понятным, почему комплексы, образованные ионами Cu +, Ag +, Zn 2+и Cd 2+, как правило, бесцветны; эти ионы имеют электронную конфигурацию d 10, так что все d-орбитали заполнены и переход электронов с d εна d γ-орбитали невозможен. Ион же Cu 2+образует окрашенные комплексы: он обладает электронной конфигурацией d 9, так что один из d ε-электронов может при возбуждении переходить на d γ-орбиталь.
- 579 -
Хотя теория кристаллического поля оказалась плодотворной с трактовке магнитных, оптических и некоторых других свойств комплексных соединений, она не смогла объяснить положения лигандов в спектрохимическом ряду, а также сам факт образования некоторых комплексов, например, так называемых «сэндвичевых» соединений — дибензолхрома Cr(C 6H 6) 2, ферроцена CFe(C 5H 5) 2и их аналогов. Дело в том, что теория кристаллического поля, учитывая влияние лигандов на центральный ион, не принимает во внимание участия электронов лигандов в образовании химических связей с центральным ионом. Поэтому применение теории кристаллического поля ограничено, главным образом, комплексными соединениями с преимущественно ионным характером связи между центральным атомом и лигандами.
Метод валентных связей в приложении к комплексным соединениям базируется на тех же представлениях, что и в простых соединениях (см. §§ 39—44). При этом принимается во внимание, что химические связи, возникающие при комплексооб-разовании имеют донорно-акцепторное происхождение, т. е. образуются за счет неподеленной электронной пары одного из взаимодействующих атомов и свободной орбитали другого атома. Рассмотрим с этих позиций строение некоторых комплексных соединений.
В молекуле аммиака атом азота находится в состоянии sp 3-гибридизации, причем на одной из его гибридных орбиталей находится неподеленная электронная пара. Поэтому при донорно-акцепторном взаимодействии молекулы NH 3с ионом H+ образуется NH 4 +имеющий тетраэдрическую конфигурацию. Аналогично построен комплексный [BF] 4 -: здесь донором электронной пары служит анион F-, а акцептором — атом бора в молекуле BF 3, обладающий незанятой орбиталью внешнего электронного слоя и переходящий при комплексообразовании в состояние sp 3-гибридизации.
Читать дальшеИнтервал:
Закладка:








