Николай Глинка - Общая химия
- Название:Общая химия
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Николай Глинка - Общая химия краткое содержание
Учебное пособие предназначено для студентов нехимических специальностей высших учебных заведений. Оно может служить пособием для лиц, самостоятельно изучающих основы химии, и для учащихся химических техникумов и старших классов средней школы.
Легендарный учебник, переведенный на многие языки стран Европы, Азии, Африки и выпущенный общим тиражом свыше 5 миллионов экземпляров.
При изготовлении файла, использован сайт http://alnam.ru/book_chem.php
Общая химия - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
При увеличении числа различных заместителей число изомеров растет и для соединений типа [MABCD] для квадратной конфигурации возможно уже три изомера.
Изучая явлеиия изомерии комплексных соединений с координационным числом 6, Вернер пришел к выводу, что в этом случае лиганды должны быть симметрично расположены вокруг центрального иона, образуя фигуру правильного октаэдра (рис. 157). Если все координированные группы одинаковы, как показано на рисунке, то, конечно, перестановка одной группы на место другой не изменит структуры комплекса. Но если группы не одинаковы, то возможно различное их расположение, вследствие чего могут образоваться изомеры. И действительно, опыт показывает, что, например, соединение [Pt(NH 3) 2Cl 4] (где координационное число платины равно 6) существует в двух изомерных формах, отличающихся одна от другой по своей окраске и другим свойствам. Строение этих изомеров, по Вернеру показано на рис. 158. В одном случае молекулы NH 3помещаются у противоположных вершин октаэдра (транс-изомер), в другом — у соседних (цис-изомер).
- 574 -
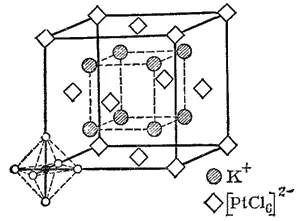
Рис. 159. Кристаллическая решетка K 2[PtCl 6].
Подобного рода пространственная изомерия наблюдается и у ряда других комплексов с шестью лигандами во внутренней сфере.
Предположения Вернера относительно октаэдрического строения комплекса с координационным числом 6 блестяще подтвердились при рентгенографическом исследовании кристаллов соответствующих соединений. На рис. 159 изображена кристаллическая решетка комплексной соли K 2[PtCl 6]. В ней комплексные ионы [PtCl 6] 2-находятся в вершинах и центрах граней куба, причем хлорид-ионы в комплексе расположены в вершинах правильного октаэдра. Таким образом, ион [PtCl 6] 2-не только сохраняется в растворах, но и является самостоятельной структурной единицей в кристаллической решетке.
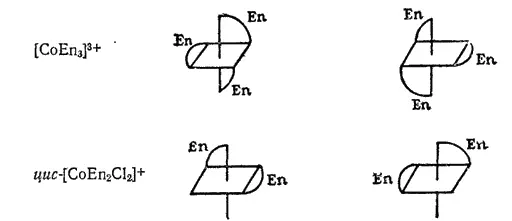
К геометрической изомерии можно отнести и зеркальную (оптическую) изомерию, рассмотренную ранее (стр. 446) на примерах органических соединений. Например, комплексы [CoEn 3]Cl 3(En — этилендиамин) и цис-[CoEn 2Cl 2]Cl существуют в виде двух зеркальных антиподов:
Кроме геометрической изомерии, известны и другие виды изомерии комплексных соединений, обусловленные различным положением и связью лигандов во внутренней сфере. Так, гидратная изомерия имеет место при переходе воды из внутренней сферы во внешнюю, например [Cr(H 2O) 6]Cl 3, [Cr(H 2O) 6Cl]Cl 2·H 2O, [Cr(H 2O) 4Cl 2]Cl·2H 2O. При этом цвет комплекса меняется от сине-фиолетового у [Cr(H 2O) 6]Cl 3до светло-зеленого у [Cr(H 2O) 4Cl 2]Cl·2H 2O (см. также § 228).
Ионизационная изомерия определяется различным распределением ионов между внутренней и внешней сферами, например: [Co(NH 3) 6Br]SO 4и [Co(NH 3) 5SO 4]Br; [Pt(NH 3) 4Cl 2]Br 2и [Pt(NH 3) 4Br 2]Cl 2.
Координационная изомерия связана с переходом лигандов от одного комплексообразователя к другому: [Co(NH 3) 6][Cr(CN) 6] и [Co(NH 3) 6]·[Co(CN) 6].
- 575 -
Имеются среди комплексных соединений и полимеры: так, составу PtCl 2·2NH 3отвечают изомерные цис- и транс-мономеры [Pt(NH 3) 2Cl 2] ,димеры [Pt(NH 3) 4][PtCl 4], [Pt(NH 3) 3Cl][Pt(NH 3)Cl 3] и тример [Pt(NH 3) 3Cl 2]·[PtCl 4].
206. Природа химической связи в комплексных соединениях.
Образование многих комплексных соединений можно в первом приближении объяснить электростатическим притяжением между центральным катионом и анионами или полярными молекулами лигандов. Наряду с силами притяжения действуют и силы электростатического отталкивания между одноименно заряженными (или, в случае полярных молекул, одинаково ориентированными) лигандами. В результате образуется устойчивая группировка атомов (ионов), обладающая минимальной потенциальной энергией.
Количественные расчеты на основе такой электростатической модели впервые были выполнены В. Косселем и А. Магнусом, которые принимали ионы за недеформируемые шары и учитывали их взаимодействие по закону Кулона. Результаты этих расчетов удовлетворительно передают зависимость координационного числа от заряда центрального иона. Однако простая электростатическая теория не в состоянии объяснить избирательность (специфичность) комплексообразования, поскольку она не принимает во внимание природу центрального атома и лигандов, особенности строения их электронных оболочек. Для учета этих факторов электростатическая теория была дополнена поляризационными представлениями (см. § 46), согласно которым комплексообразованию благоприятствует участие в качестве центральных атомов небольших многозарядных катионов d-элементов, обладающих сильным поляризующим действием, а в качестве лигандов — больших, легко поляризующихся ионов или молекул. В этом случае происходит деформация электронных оболочек центрального атома и лигандов, приводящая к их взаимопроникновению, что и вызывает упрочнение связей.
Поляризационные представления оказались полезными для объяснения устойчивости, кислотно-основных и окислительно-восстановительных свойств комплексных соединений, но многие другие их свойства остались необъясненными. Так, с позиций электростатической теории все комплексы с координационным числом 4 должны иметь тетраэдрическое строение, поскольку именно такой конфигурации соответствует наименьшее взаимное отталкивание лигандов. В действительности, как мы уже знаем, некоторые подобные комплексы, например, образованные платиной (II), построены в форме плоского квадрата. Электростатическая теория не в состоянии объяснить особенности реакционной способности комплексных соединений, их магнитные свойства и окраску. Более точное и полное описание свойств и строения комплексных соединений может быть получено только на основе квантовомеханических представлений о строении атомов и молекул.
В настоящее время существует несколько подходов к квантовомеханическому описанию строения комплексных соединений.
- 576 -
Теория кристаллического поля основана на представлении об электростатической природе взаимодействия между центральным ионом и лигандами. Однако, в отличие от простой ионной теории, здесь учитывается различное пространственное расположение d-орбиталей (см. рис. 20 на стр. 81) и связанное с этим различное изменение энергии d-электронов центрального атома, вызываемое их отталкиванием от электронных облаков лигандов.
Рассмотрим состояние σ-орбиталей центрального иона. В свободном ионе электроны, находящиеся на каждой из пяти σ-орбиталей, обладают одинаковой энергией (рис. 160, а). Представим себе, что лиганды создают равномерное сферическое электростатическое поле, в центре которого находится центральный ион. В этом гипотетическом случае энергия d-орбиталей за счет отталкивающего действия лигандов возрастает на одинаковую величину, т. е. все d-орбитали останутся энергетически равноценными (рис. 160,6). В действительности, однако, лиганды неодинаково действуют на различные d-орбитали: если орбиталь расположена близко к лиганду, энергия занимающего ее электрона возрастает более значительно, чем в том случае, когда орбиталь удалена от лиганда. Например, при октаэдрическом расположении лигандов вокруг центрального иона наибольшее отталкивание испытывают электроны, находящиеся на орбиталях d z 2и d x 2-y 2направленных к лигандам (рис. 161, а и б); поэтому их энергия будет более высокой, чем в гипотетическом сферическом поле. Напротив, d xy, d xzи d yz-орбитали направлены между лигандами (рис. 161, в), так что энергия находящихся здесь электронов будет ниже, чем в сферическом поле. Таким образом, в октаэдрическом поле лигандов происходит расщепление d-уровня центрального иона на два энергетических уровня (рис. 160, в): более высокий уровень, соответствующий орбиталям d z 2и d x 2-y 2(их принято обозначать d γили ε g), и более низкий уровень, отвечающий орбиталям d xy, d xzи d yz(эти орбитали обозначают d εили t 2g).
Читать дальшеИнтервал:
Закладка:








