Николай Глинка - Общая химия
- Название:Общая химия
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Николай Глинка - Общая химия краткое содержание
Учебное пособие предназначено для студентов нехимических специальностей высших учебных заведений. Оно может служить пособием для лиц, самостоятельно изучающих основы химии, и для учащихся химических техникумов и старших классов средней школы.
Легендарный учебник, переведенный на многие языки стран Европы, Азии, Африки и выпущенный общим тиражом свыше 5 миллионов экземпляров.
При изготовлении файла, использован сайт http://alnam.ru/book_chem.php
Общая химия - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
203. Основные положения координационной теории.
Согласно координационной теории, в молекуле любого комплексного соединения один из ионов, обычно положительно заряженный, занимает центральное место и называется комплексообразователем или центральным ионом. Вокруг него в непосредственной близости расположено или, как говорят, координировано некоторое число противоположно заряженных ионов или электронейтральных молекул, называемых лигандами (или аддендами) и образующих внутреннюю координационную сферу соединения. Остальные ионы, не разместившиеся во внутренней сфере, находятся на более далеком расстоянии от центрального иона, составляя внешнюю координационную сферу. Число лигандов, окружающих центральный ион, называется координационным числом.
Внутренняя сфера комплекса в значительной степени сохраняет стабильность при растворении. Ее границы показывают квадратными скобками. Ионы, находящиеся во внешней сфере, в растворах легко отщепляются. Поэтому говорят, что во внутренней сфере ионы связаны не ионогенно, а во внешней — неионогенно. Например, координационная формула комплексной соли состава PtCl 4·2KCl такова: K 2[PtCl 6]. Здесь внутренняя сфера состоит из. центрального атома платины в степени окисленности +4 и хлоридионов, а ионы калия находятся во внешней сфере.
Не следует думать, что комплексные соединения всегда построены из ионов; в действительности эффективные заряды атомов и молекул, входящих в состав комплекса, обычно невелики.

Альфред Вернер (1866—1919)
- 565 -
Более правильно поэтому пользоваться термином «центральный атом». Ионные представления о природе связи в комплексных соединениях носят в некоторой степени формальный характер, однако они удобны для классификации и определения зарядов комплексов и позволяют качественно предсказать некоторые их свойства.
Координационная теория Вернера является руководящей в химии комплексных соединений и в настоящее время. С течением времени изменяются и уточняются лишь представления о силах, действующих между центральным атомом и лигандами (см. § 206). Широкое распространение этой теории объясняет, почему комплексные соединения часто называют «координационными соединениями».
Существует ряд методов установления координационных формул комплексных соединений.
С помощью реакций двойного обмена. Именно таким путем была доказана структура следующих комплексных соединений платины: PtCl 4·6NH 3, PtCl 4·4NH 3, PtCl 4·2NH 3, PtCl 4·2KCl.
Если подействовать на раствор первого соединения раствором AgNO 3, то весь содержащийся в нем хлор осаждается в виде хлорида серебра. Очевидно, что все четыре хлорид-иона находятся во внешней сфере и, следовательно, внутренняя сфера состоит только из молекул аммиака. Таким образом, координационная формула соединения будет [Pt(NH 3) 6]Cl 4. В соединении PtCl 4·4NH 3нитрат серебра осаждает только половину хлора, т. е. во внешней сфере находятся только два хлорид-иона, а остальные два вместе с четырьмя молекулами аммиака входят в состав внутренней сферы, так что координационная формула имеет вид [Pt(NH 3) 4Cl 2]Cl 2. Раствор соединения PtCl 4·2NH 3не дает осадка с AgNO 3, это соединение изображается формулой [Pt(NH 3) Cl 4]. Наконец, из раствора соединения PtCl 4·2KCl нитрат серебра тоже не осаждает AgCl, но путем обменных реакций можно установить, что в растворе имеются ионы калия. На этом основании строение его изображается формулой K 2[PtCl 6].
По молярной электрической проводимости разбавленных растворов. При сильном разбавлении молярная электрическая проводимость μ комплексного соединения определяется зарядом и числом образующихся ионов. Для соединений, содержащих комплексный ион и однозарядные катионы или анионы, имеет место следующее примерное соотношение:
- 566 -
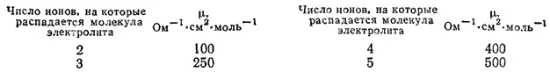
Измерение электрической проводимости подтверждает приведенные выше координационные формулы комплексов платины. Электрическая проводимость их изменяется, как показано на диаграмме (рис. 155). Для первого соединения μ≈500 , что указывает на образование при его диссоциации пяти ионов и соответствует координационной формуле [Pt(NH 3) 6]Cl 4. По мере замещения во внутренней сфере молекул NH 3на ионы Cl- электрическая проводимость падает и становится минимальной для неэлектролита [Pt(NH 3) 2Cl 4]. При переходе к соединению K 2[PtCl 6] электрическая проводимость вновь возрастает, а значение ее соответствует образованию при диссоциации трех ионов.
Рентгеноструктурным методом. Координационная формула комплексного соединения, находящегося в кристаллическом состоянии, может быть непосредственно установлена путем определения взаимного положения атомов и молекул в кристалле рентгеноструктурным методом (см. § 50). Однако для этого требуется вырастить достаточно крупный и неискаженный кристалл комплексного соединения, что не всегда возможно.
Существует и ряд других физико-химических методов установления координационных формул комплексных соединений.
Анализируя координационные числа многих комплексных соединений, А. Вернер пришел к выводу, что заряд центрального иона (или, точнее, степень окисленности центрального атома) является основным фактором, влияющим на координационное число. Ниже сопоставлены наиболее характерные координационные числа в растворах и заряд центрального иона:
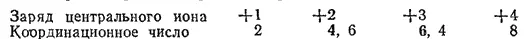
Здесь выделены жирным шрифтом чаще встречающиеся координационные числа в тех случаях, когда возможны два различных типа координации. Координационное число 6 встречается в комплексных соединениях Pt 4+, Cr 3+, Co 3+, Fe 3+координационное число 4 — в комплексах Cu 2+, Zn 2+, Pd 2+, Pt 2+координационное число 2 — в комплексах Ag +, Cu +. Приведенные координационные числа соответствуют максимальному насыщению координационной сферы и относятся к координационно-насыщенным соединениям.
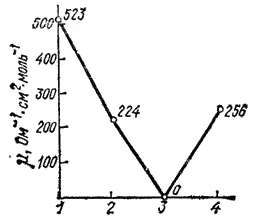
Рис. 155. Изменение молярной электрической проводимости μ, в ряду комплексных соединений платины(IV) : 1 [Pt(NH 3) 6]Cl 4; 2 [Pt(NH 3) 4Cl 2]Cl 2; 3 [Pt(NH 3) 2Cl 4]; 4 K 2[PtCl 6].
- 567 -
Не всегда в растворах соблюдаются условия, необходимые для этого, и тогда образуются координационно-ненасыщенные комплексы с меньшими координационными числами.
Координационное число не является неизменной величиной для данного комплексообразователя, а обусловлено также природой лиганда, его электронными свойствами. Даже для одних и тех же комплексообразователей и лигандов координационное число зависит от агрегатного состояния, от концентрации компонентов и температуры раствора.
Читать дальшеИнтервал:
Закладка:








