Николай Глинка - Общая химия
- Название:Общая химия
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Николай Глинка - Общая химия краткое содержание
Учебное пособие предназначено для студентов нехимических специальностей высших учебных заведений. Оно может служить пособием для лиц, самостоятельно изучающих основы химии, и для учащихся химических техникумов и старших классов средней школы.
Легендарный учебник, переведенный на многие языки стран Европы, Азии, Африки и выпущенный общим тиражом свыше 5 миллионов экземпляров.
При изготовлении файла, использован сайт http://alnam.ru/book_chem.php
Общая химия - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
В серебряно-цинковых аккумуляторах, обладающих хорошими электрическими характеристиками и имеющих малую массу и объем, электродами служат оксиды серебра Ag 2O, AgO (катод) и губчатый цинк (анод); электролитом служит раствор КОН.
При работе аккумулятора цинк окисляется, превращаясь в ZnO и Zn(OH) 2, а оксид серебра восстанавливается до металла. Суммарную реакцию, протекающую при разряде аккумулятора, можно приближенно выразить уравнением:
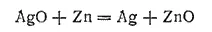
Э. д. с. заряженного серебряно-цинкового аккумулятора приближенно равна 1,85 В. При снижении напряжения до 1,25 В аккумулятор заряжают. При этом процессы электродах «обращаются»: цинк восстанавливается, серебро окисляется — вновь получаются вещества, необходимые для работы аккумулятора.
Серебро — малоактивный металл. В атмосфере воздуха оно не окисляется ни при комнатных температурах, ни при нагревании. Часто наблюдаемое почернение серебряных предметов — результат образования на их поверхности черного сульфида серебра Ag 2S. Это происходит под влиянием содержащегося в воздухе сероводорода (см. стр. 371), а также при соприкосновении серебряных предметов с пищевыми продуктами, содержащими соединения серы.
В ряду напряжений серебро расположено значительно дальше водорода. Поэтому соляная и разбавленная серная кислоты на него не действуют. Растворяют серебро обычно в азотной кислоте, которая взаимодействует с ним согласно уравнению:
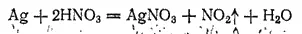
Серебро образует один ряд солей, растворы которых содержат бесцветные катионы Ag +.
Оксид серебра(I), или закись серебра, Ag 2O. При действии щелочей на растворы солей серебра можно ожидать получения AgOH, но вместо него выпадает бурый осадок оксида серебра(I):
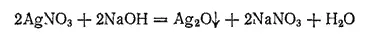
Оксид серебра (I) незначительно растворяется в воде (0,017 г/л), Получающийся раствор имеет щелочную реакцию и, подобий щелочам, осаждает гидроксиды некоторых металлов из растворов их солей. Очевидно, в растворе содержится гидроксид серебра AgOH, представляющий собой довольно сильное основание.
* Содержание серебра или золота в сплаве указывает проба, которая ставится на изделии в виде клейма. В Советском Союзе применяется метрическая система проб. Метрическая проба показывает, сколько единиц массы драгоценного металла содержится в 1000 единицах массы сплава. наиболее распространены изделия из серебра 800 и 875 пробы, из золота - 583 и 750
- 560 -
Последнее подтверждается тем, что соли серебра не гидролизуются.
Кроме оксида серебра(I) известны оксиды AgO и Ag 2O 3.
Наибольшее значение имеют следующие соли серебра.
Нитрат серебра AgNO 3, называемый также ляписом. Образует бесцветные прозрачные кристаллы, хорошо растворимые в воде. Применяется в производстве фотоматериалов, при изготовлении зеркал, в гальванотехнике, в медицине.
Хлорид серебра AgCl образуется в виде белого творожистого нерастворимого в воде и кислотах осадка при взаимодействии ионов серебра с хлорид-ионами. На свету хлорид серебра постепенно темнеет, разлагаясь с выделением металлического серебра. Такими же свойствами обладают бромид и иодид серебра, имеющие в отличие от хлорида серебра желтоватый цвет. Напротив, фторид серебра AgF растворим в воде.
Комплексные соединения серебра. Подобно меди, серебро обладает склонностью к образованию комплексных соединений.
Многие нерастворимые в воде соединения серебра, например оксид серебра(I) и хлорид серебра, легко растворяются в водном растворе аммиака. Причина растворения заключается в образовании комплексных ионов [Ag(NH 3) 2] +. Например, равновесия, устанавливающиеся при взаимодействии хлорида серебра с водным раствором аммиака, можно представить следующей схемой:
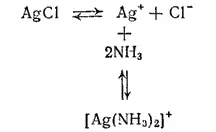
В насыщенном растворе хлорида серебра устанавливается динамическое равновесие между ионами Ag +и Cl -и осадком AgCl. Вводимые в раствор молекулы аммиака связываются с ионами серебра в комплексные ионы [Ag(NH 3) 2] +и осадок растворяется. Таким образом, в аммиачном растворе серебро находится в виде комплексных катионов [Ag(NH 3) 2] +. Но наряду с ними в растворе всегда остается и некоторое, хотя и незначительное количество ионов серебра вследствие диссоциации комплексного иона согласно уравнению:

Комплексные цианистые соединения серебра применяются для гальванического серебрения, так как при электролизе растворов этих солей на поверхности изделий осаждается плотный слой мелкокристаллического серебра.
- 561 -
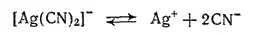
При пропускании тока через раствор K[Ag(CN) 2] серебро выделяется на катоде за счет незначительного количества ионов серебра, которое получается вследствие диссоциации комплексного аниона:
Все соединения серебра легко восстанавливаются с выделением металлического серебра. Если к аммиачному раствору оксида серебра(I), находящемуся в стеклянном сосуде, прибавить в качестве восстановителя немного глюкозы или формалина, то металлическое серебро выделяется в виде плотного блестящего зеркального слоя на поверхности стекла. Этим способом готовят зеркала, а также серебрят внутреннюю поверхность стекла в сосудах Дьюара и в термосах для уменьшения потери теплоты лучеиспусканием.
Соли серебра, особенно хлорид и бромид, ввиду их способности разлагаться под влиянием света с выделением металлического серебра, широко используются для изготовления фотоматериалов — пленки, бумаги, пластинок. Фотоматериалы обычно представляют собой светочувствительную суспензию AgBr в желатине, слой которой нанесен на целлулоид, бумагу или стекло.
При экспозиции в тех местах светочувствительного слоя, где на него попал свет, образуются мельчайшие зародыши кристаллов металлического серебра. Это — скрытое изображение фотографируемого предмета. При проявлении бромид серебра разлагается, причем скорость разложения тем больше, чем выше концентрация зародышей в данном месте слоя. Получается видимое изображение, которое является обращенным, или негативны и, изображением, поскольку степень почернения в каждом месте светочувствительного слоя тем больше, чем выше была его освещенность при экспозиции. В ходе закрепления (фиксирования) из светочувствительного слоя удаляется неразложившийся бромид серебра. Это происходит в результате взаимодействия между AgBr и веществом закрепителя — тиосульфатом натрия. При этой реакции получается растворимая комплексная соль:
Читать дальшеИнтервал:
Закладка:








