Николай Глинка - Общая химия
- Название:Общая химия
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Николай Глинка - Общая химия краткое содержание
Учебное пособие предназначено для студентов нехимических специальностей высших учебных заведений. Оно может служить пособием для лиц, самостоятельно изучающих основы химии, и для учащихся химических техникумов и старших классов средней школы.
Легендарный учебник, переведенный на многие языки стран Европы, Азии, Африки и выпущенный общим тиражом свыше 5 миллионов экземпляров.
При изготовлении файла, использован сайт http://alnam.ru/book_chem.php
Общая химия - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
Подобно натрию, калий образует соли со всеми кислотами. Важнейшие из них были рассмотрены при описании свойств соответствующих кислот.
Как и натрий, калий содержится во всех тканях организма человека. Но, в отличие от натрия, калий в преобладающем количестве находится внутри клеток. Ион калия играет важную роль в некоторых физиологических и биохимических процессах, например, он участвует в проведении нервных импульсов. Определенная концентрация калия в крови необходима для нормальной работы сердца. В организм калий поступает главным образом с растительной пищей; суточная потребность взрослого человека в нем составляет 2—3 г.
К подгруппе меди относятся три элемента — медь, серебро и золото. Подобно атомам щелочных металлов, атомы всех этих элементов имеют в наружном слое по одному электрону; но предпоследний их электронный слой содержит, в отличие от атомов щелочных металлов, восемнадцать электронов. Структуру двух внешних электронных оболочек атомов этих элементов можно изобразить формулой (n-1)s 2(n-1)p 6(n-1)d 10ns 1(где n — номер периода, в котором находится данный элемент). Все элементы подгруппы меди — предпоследние члены декад d-элементов. Однако, как видно из приведенной формулы, их атомы содержат на (n-1)d-подуровне не 9, а 10 электронов. Это объясняется тем, что структура (n-1)d 10s 1более устойчива, чем структура (n-1)d 10s 2(см. стр. 93).
В табл. 31 приведены некоторые физические константы, характеризующие элементы подгруппы меди.
Сравнивая данные табл. 31 с соответствующими величинами для щелочных металлов (табл. 30), можно видеть, что радиусы атомов меди, серебра и золота меньше радиусов атомов металлов главной подгруппы. Это обусловливает значительно большую плотность, высокие температуры плавления и большие величины энтальпии атомизации рассматриваемых металлов; меньшие по размеру атомы располагаются в решетке более плотно, вследствие чего силы притяжения между ними велики.
Малый радиус атомов объясняет также более высокие значения энергии ионизации металлов этой подгруппы, чем щелочных металлов.
- 552 -
Таблица 31. Некоторые свойства меди и ее аналогов
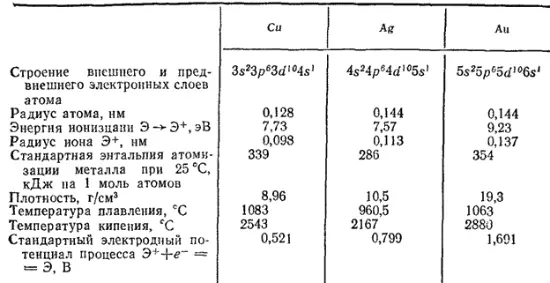
Это приводит к большим различиям в химических свойствах металлов обеих подгрупп. Элементы подгруппы меди — малоактивные металлы. Они с трудом окисляются, и, наоборот, их ионы легко восстанавливаются; они не разлагают воду, гидроксиды их являются сравнительно слабыми основаниями. В ряду напряжений они стоят после водорода. В то же время восемнадцатиэлектронный слой, устойчивый у других элементов, здесь еще не вполне стабилизировался и способен к частичной потере электронов. Так, медь наряду с однозарядными катионами образует и двухзарядные, которые для нее даже более характерны. Точно так же для золота степень окисленности +3 более характерна, чем +1. Степень окисленности серебра в его обычных соединениях равна +1 однако известны соединения со степенью окисленности серебра +2 и +3.
200. Медь. (Cuprum).
Общее содержание меди в земной коре сравнительно невелико [0,01% (масс.)], однако она чаще, чем другие металлы, встречается в самородном состоянии, причем самородки меди достигают значительной величины. Этим, а также сравнительной легкостью обработки меди объясняется то, что она ранее других металлов была использована человеком.
В настоящее время медь добывают из руд. Последние, в зависимости от характера входящих в их состав соединений, подразделяют на оксидные и сульфидные. Сульфидные руды имеют наибольшее значение, поскольку из них выплавляется 80 % всей добываемой меди.
Важнейшими минералами, входящими в состав медных руд, являются: халькозин, или медный блеск, Cu 2S; халькопирит, или медный колчедан, CuFeS 2; малахит (CuOH) 2CO 3.
- 553 -
В СССР богатые месторождения медных руд находятся на Урале, в Казахстане и в Закавказье.
Медные руды, как правило, содержат большое количество пустой породы, так что непосредственное получение из них меди экономически невыгодно. Поэтому в металлургии меди особенно важную роль играет обогащение (обычно флотационный метод), позволяющее использовать ряды с небольшим содержанием меди.
Выплавка меди из ее сульфидных руд или концентратов представляет собою сложный процесс. Обычно он слагается из следующих операций: обжиг, плавка, конвертирование, огневое и электролитическое рафинирование. В ходе обжига большая часть сульфидов примесных элементов превращается в оксиды. Так, главная примесь большинства медных руд пирит FeS 2превращается в Fe 2O 3. Газы, отходящие при обжиге, содержат SO 2и используются для получения серной кислоты.
Получающиеся в ходе обжига оксиды железа, цинка и других примесей отделяются в виде шлака при плавке. Основной же продукт плавки — жидкий штейн (Cu 2S с примесью FeS) поступает в конвертор, где через пего продувают воздух. В ходе конвертирования выделяется диоксид серы и получается черновая, или сырая, медь.
Для извлечения ценных спутников ( Au, Ag, Te и др.) и для удаления вредных примесей черновая медь подвергается огневому, а затем электролитическому рафинированию. В ходе огневого рафинирования жидкая медь насыщается кислородом. При этом примеси железа, цинка, кобальта окисляются, переходят в шлак и удаляются. Медь же разливают в формы. Получающиеся отливки служат анодами при электролитическом рафинировании (см. § 103).
Чистая медь — тягучий вязкий металл светло-розового цвета, легко прокатываемый в тонкие листы. Она очень хорошо проводит теплоту и электрический ток, уступая в этом отношении только серебру. В сухом воздухе медь почти не изменяется, так как образующаяся на ее поверхности тончайшая пленка оксидов (придающая меди более темный цвет) служит хорошей защитой от дальнейшего окисления. Но в присутствии влаги и диоксида углерода поверхность меди покрывается зеленоватым налетом карбоната гидроксомеди (CuOH) 2CO 3. При нагревании на воздухе в интервале температур 200-375°C медь окисляется до черного оксида меди (II) CuO. При более высоких температурах на ее поверхности образуется двухслойная окалина: поверхностный слой представляет собой оксид меди (II), а внутренний — красный оксид меди (I). Ввиду высокой теплопроводности, электрической проводимости, ковкости, хороших литейных качеств, большого сопротивления на разрыв и химической стойкости медь широко используется в промышленности.
Большие количества чистой электролитической меди (около 40% всей добываемой меди) идут на изготовление электрических проводов и кабелей. Из меди изготовляют различную промышленную аппаратуру: котлы, перегонные кубы и т. п.
Читать дальшеИнтервал:
Закладка:








