Николай Глинка - Общая химия
- Название:Общая химия
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Николай Глинка - Общая химия краткое содержание
Учебное пособие предназначено для студентов нехимических специальностей высших учебных заведений. Оно может служить пособием для лиц, самостоятельно изучающих основы химии, и для учащихся химических техникумов и старших классов средней школы.
Легендарный учебник, переведенный на многие языки стран Европы, Азии, Африки и выпущенный общим тиражом свыше 5 миллионов экземпляров.
При изготовлении файла, использован сайт http://alnam.ru/book_chem.php
Общая химия - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
На этой реакции основано применение пероксида натрия для регенерации воздуха в изолированных помещениях.
Гидроксид натрия NaOH образует твердые белые, очень гигроскопичные кристаллы, плавящиеся при 322°C. Ввиду сильного разъедающего действия на ткани, кожу, бумагу и другие органические вещества он называется также едким натром («натр» — старое название оксида натрия). В технике гидроксид натрия часто называют каустической содой.
В воде гидроксид натрия растворяется с выделением большого количества теплоты вследствие образования различных гидратов.
Гидроксид натрия следует хранить в хорошо закупоренных сосудах, так как он легко поглощает из воздуха диоксид углерода, постепенно превращаясь в карбонат натрия.
Основным способом получения гидроксида натрия является электролиз водного раствора хлорида натрия. В ходе электролиза на катоде разряжаются ионы водорода и одновременно вблизи катода накапливаются ноны натрия и гидроксид-ионы, т. е. получается гидроксид натрия; на аноде выделяется хлор.
- 549 -
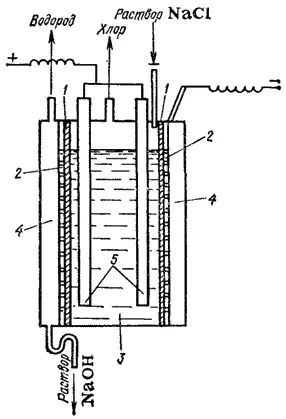
Рис. 154. Схема электролизера с вертикальной диафрагмой: 1 - диафрагма; 2 — катод; 3 — анодное пространство; 4 — катодное пространство; 5 — аноды.
Очень важно, чтобы продукты электролиза не смешивались, так как гидроксид натрия легко взаимодействует с хлором; в результате образуются хлорид и гипохлорит натрия:
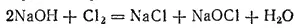
Для того чтобы воспрепятствовать проникновению хлора в раствор гидроксида натрия, чаще всего применяют диафрагменный способ, при котором анодное и катодное пространства отделены друг от друга перегородкой (диафрагмой) из асбеста или другого пористого материала.
В электролизерах, служащих для получения гидроксида натрия по этому способу (рис. 154), вертикально установленная диафрагма 1, плотно прилегающая к стальному дырчатому катоду 2, отделяет анодное пространство 3 от катодного 4 и препятствует смешиванию продуктов электролиза. Анодами служат графитовые стержни 5. В процессе электролиза в анодное пространство непрерывно поступает раствор хлорида натрия, а из катодного вытекает раствор, содержащий смесь хлорида и гидоксида натрия. При его выпаривании выкристаллизовывается хлорид натрия и остается почтя чистый раствор щелочи. Последний отделяют от хлорида натрия и выпаривают до полного удаления воды. Полученный NaOH сплавляют и отливают в формы. Побочными продуктами при получении гидроксида натрия являются хлор и водород.
Несколько иначе протекает электролиз раствора хлорида натрия, если катодом служит металлическая ртуть. Перенапряжение выделения водорода на ртути очень велико. Поэтому здесь у катода разряжаются не ионы водорода, а ионы натрия. Выделяющийся натрий растворяется в ртути, образуя амальгаму натрия. Амальгаму разлагают горячей водой, причем получается гидроксид натрия, выделяется водород и освобождается ртуть. Таким образом, пользуясь в качестве катода ртутью, можно получать чистый гидроксид натрия, не содержащий в виде примеси хлорид натрия.
Кроме электролитического способа получения гидроксида натрия, иногда еще применяют более старый способ — кипячение раствора соды с гашеной известью:
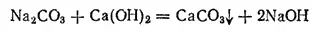
По окончании реакции раствор сливают с осадка карбоната кальция и, выпарив воду, сплавляют полученный гидроксид натрия.
Гидроксид натрия — один из важнейших продуктов основной химической промышленности.
- 550 -
В больших количествах он потребляется для очистки продуктов переработки нефти; гидроксид натрия широко применяется в мыловаренной, бумажной, текстильной и других отраслях промышленности, а также при производстве искусственного волокна.
Только в СССР в 1985 г. было произведено 3.1 млн. т NaOH.
Натрий образует соли со всеми известными кислотами. Важнейшие из них были описаны при рассмотрении свойств соответствующих кислот. Многие соли натрия образуют кристаллогидраты с довольно большим содержанием кристаллизационной воды (например, Na 2S 2O 3·5H 2O, Na 2CO 3·10H 2O, Na 2SO 4·10H 2O).
В организме человека натрий в виде его растворимых солей, главным образом хлорида, фосфата и бикарбоната, содержится в основном во внеклеточных жидкостях — плазме крови, лимфе, пищеварительных соках. Осмотическое давление плазмы крови поддерживается на необходимом уровне прежде всего за счет хлорида натрия.
199. Калий (Kalium).
По внешнему виду, а также по физическим и химическим свойствам калий очень похож на натрий, но обладает еще большей активностью. Подобно натрию он имеет серебристо-белый цвет, быстро окисляется на воздухе и бурно реагирует с водой с выделением водорода.
Гидроксид калия, или едкое кали, КОН получается аналогично гидроксиду натрия — электролизом раствора хлорида калия. Хотя действие его такое же, как и гидроксида натрия, но применяется он гораздо реже, ввиду его более высокой стоимости.
Соли калия очень сходны с солями натрия, но обычно выделяются из растворов без кристаллизационной воды.
Калий принадлежит к числу элементов, необходимых в значительном количестве для питания растений. Хотя в почве находится довольно много солей калия, но и уносится его с некоторыми культурными растениями также очень много. Особенно много калия уносят лен, конопля и табак.
Калий отлагается в растениях главным образом в стеблях, поэтому удобрение земли навозом, содержащим солому, отчасти пополняет убыль калия. Но так как стебли перечисленных выше растений используются для промышленных целей, то в конце концов большая часть калия уходит из почвы, и для пополнения его убыли необходимо вносить в почву калийные удобрения.
Источником получения калийных удобрений служат естественные отложения калийных солей. В СССР такие отложения находятся в районе Соликамска. Пласты соли, состоящие главным образом из минералов карналлита KCl·MgCl 2·6H 2O и сильвинита KCl·NaCl, залегают на большой площади между верховьями Камы и предгорьями Урала. В пределах СССР калийные месторождения имеются также в Саратовской области и в Западной Украине. По запасам калийных солей наша страна занимает первое место в мире.
- 551 -
В качестве калийных удобрений применяют как природные вещества, так и продукты их переработки. Из природных веществ используется главным образом сильвинит. Продуктами переработки, находящими наибольшее применение, являются хлорид и сульфат калия. Иногда применяется также растительная зола, содержащая калий главным образом в виде карбоната.
Читать дальшеИнтервал:
Закладка:








