Николай Глинка - Общая химия
- Название:Общая химия
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Николай Глинка - Общая химия краткое содержание
Учебное пособие предназначено для студентов нехимических специальностей высших учебных заведений. Оно может служить пособием для лиц, самостоятельно изучающих основы химии, и для учащихся химических техникумов и старших классов средней школы.
Легендарный учебник, переведенный на многие языки стран Европы, Азии, Африки и выпущенный общим тиражом свыше 5 миллионов экземпляров.
При изготовлении файла, использован сайт http://alnam.ru/book_chem.php
Общая химия - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
Лиганды, занимающие во внутренней координационной сфере одно место, называются монодентатными, Существуют лиганды, занимающие во внутренней сфере два или несколько мест, Такие лиганды называются би- и полидентатными.
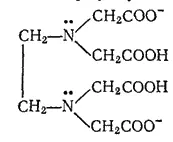
Примерами бидентатных лигандов могут служить оксалатный ион C 2O 4 2-(или 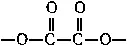 ) и молекула этилендиамина (NH 2CH 2CH 2NH 2). Четырехдентатным лигандом является двухзарядный анион этилендиаминтетрауксусной кислоты:
) и молекула этилендиамина (NH 2CH 2CH 2NH 2). Четырехдентатным лигандом является двухзарядный анион этилендиаминтетрауксусной кислоты:
Заряд комплексного иона равен алгебраической сумме зарядов составляющих его простых ионов. Например:
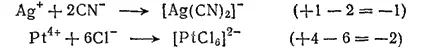
Входящие в состав комплекса электронейтральные молекулы, например NH 3, H 2), C 2H 4не влияют на величину его заряда. Поэтому при определении заряда комплексных ионов их можно не учитывать. Заряд комплексообразователя, в свою очередь, легко находится, исходя из заряда комплексного иона и зарядов содержащихся в комплексе лигандов.
Нейтральные молекулы или анионы, находящиеся во внутренней сфере комплексного соединения, могут быть последовательно замещены другими молекулами или анионами. Например, путем замещения молекул аммиака в комплексной соли [Co(NH 3) 6]Cl 3ионами NO 2получают следующие соединения: [Co(NH 3) 5(NO 2)]Cl 2, [Co(NH 3) 3(NO 2) 3], K 2[Co(NH 3) 3(NO 2) 5], K 3[Co(NO 2) 6]. Понятно, что при таком замещении постепенно изменяется и заряд комплексного иона, понижаясь от +3 у иона [Co(NH 3) 6] 3+до —3 у иона [Co(NO 2) 6] 3-.
- 568 -
204. Основные типы и номенклатура комплексных соединений.
К основным типам комплексных соединений относятся следующие.
Аммиакаты — комплексы, в которых лигандами служат молекулы аммиака, например: [Cu(NH 3) 4]SO 4, [Co(NH 3) 6]Cl 3, [Pt(NH 3) 6]Cl 4. Известны комплексы, аналогичные аммиакатам, в которых роль лиганда выполняют молекулы аминов: CH 3NH 2(метиламин), C 2H 5NH 2(этиламин), NH 2CH 2CH 2NH 2(этилендиамин, условно обозначаемый Еп) и др. Такие комплексы называют аминатами.
Аквакомплексы — в которых лигандом выступает вода: [Co(H 2O) 6]Cl 2[Al(H 2O) 6]Cl 3[Cr(H 2O) 6]Cl 3и др. Находящиеся в водном растворе гидратированные катионы содержат в качестве центрального звена аквакомплекс. В кристаллическом состоянии некоторые из аквакомплексов удерживают и кристаллизационную воду, например: [Cu(H 2O) 4]SO 4·H 2O, [Fe(H 2O) 6]SO 4·H 2O. Кристаллизационная вода не входит в состав внутренней сферы, она связана менее прочно, чем координированная, и легче отщепляется при нагревании.
Ацидокомплексы. В этих комплексах лигандами являются анионы. К ним относятся комплексы типа двойных солей, например K 2[PtCl 4], K 4[Fe(CN) 6] (их можно представить как продукт сочетания двух солей — PtCl 4·2KCl Fe(CN) 2·4KCN и т. п.), комплексные кислоты — H 2[SiF 6], H 2[CoCl 4], гидроксокомплексы — Na 2[Sn(OH) 4], Na 2[Sn(OH) 6] и др.
Между этими классами существуют переходные ряды, которые включают комплексы с различными лигандами. О таких комплексах мы уже упоминали. Приведем переходный ряд между аммиакатами и ацидокомплексами платины(II) [Pt(NH 3) 4]Cl 2, [Pt(NH 3) 3Cl]Cl, [Pt(NH 3) 2Cl 2], K[Pt(NH 3)Cl 3], K[PtCl 4].
Циклические, или хелатные (клешневидные), комплексные соединения. Они содержат би- или полидентатный лиганд, который как бы захватывает центральный атом подобно клешням рака:
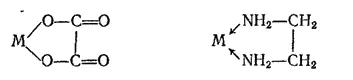
В этих комплексах символом М обозначен атом металла, а стрелкой — донорно-акцепторная связь. Примерами таких комплексов служат оксалатный комплекс железа(III) [Fe(C 2O 4) 3] 3-и этилендиаминовый комплекс платины(IV) -[PtEn 3] 4+. К группе хелатов относятся и внутрикомплексные соединения, в которых центральный атом входит в состав цикла, образуя ковалентные связи с лигандами разными способами: донорно-акцепторным и за счет неспаренных атомных электронов. Комплексы такого рода весьма характерны для аминокарбоновых кислот.
- 569 -
Простейший их представитель — амииоуксусная кислота (глицин) NH 2CH 2COOH — образует хелаты с ионами Cu 2+, Pt 2+, Rh 3+, например:
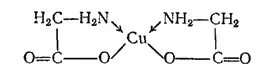
Известны также комплексы с более сложными амннокарбоновыми кислотами и их аналогами. Такие лиганды называются комплексонами. Двухзарядный анион этилендиамиптетрауксусной кислоты, называемый в виде двунатриевой соли комплексоном III, или трилоном Б, дает с двухвалетным металлом комплекс типа:
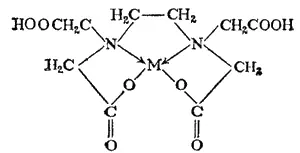
Хелатные соединения отличаются особой прочностью, так как центральный атом в них как бы «блокирован» циклическим лигандом. Наибольшей устойчивостью обладают хелаты с пяти- и шестичленными циклами. Комплексоны настолько прочно связывают катионы металлов, что при их добавлении растворяются такие плохо растворимые вещества, как сульфаты кальция и бария, оксалаты и карбонаты кальция. Поэтому их применяют для умягчения воды, для маскировки «лишних» ионов металла при крашении и изготовлении цветной пленки. Большое применение они находят и в аналитической химии.
Многие органические лиганды хелатного типа являются весьма чувствительными и специфическими реагентами на катионы переходных металлов. К ним относится, например, диметилглиоксим, предложенный Л. А. Чугаевым как реактив на ионы Ni 2+, и Pd 2+,.

Лев Александрович Чугаев (1873—1922)
Лев Александрович Чугаев принадлежит к числу наиболее выдающихся советских химиков. Родился в Москве, в 1895 г. окончил Московский университет. В 1904-1908 — профессор Московского высшего технического училища, в 1908—1922 г. — профессор неорганической химии Петербургского университета и одновременно (с 1909 г.) - профессор органической химии Петербургского технологического института.
- 570 -
Занимался изучением химии комплексных соединений переходных металлов, в особенности металлов платиновой группы. Открыл много новых комплексных соединений, важных в теоретическом и практическом отношениях. Чугаев впервые обратил внимание на особую устойчивость 5- и 6-членных циклов во внутренней сфере комплексных соединений и охарактеризовал кислотно-основные свойства аммиакатов платины (IV). Он был одним из основоположников применения органических реагентов в аналитической химии. Много внимания уделял организации и развитию промышленности по добыче и переработке платины и платиновых металлов в СССР. Создал большую отечественную школу химиков-неоргаников, работающих в области изучения химии комплексных соединений.
Читать дальшеИнтервал:
Закладка:








