Николай Глинка - Общая химия
- Название:Общая химия
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Николай Глинка - Общая химия краткое содержание
Учебное пособие предназначено для студентов нехимических специальностей высших учебных заведений. Оно может служить пособием для лиц, самостоятельно изучающих основы химии, и для учащихся химических техникумов и старших классов средней школы.
Легендарный учебник, переведенный на многие языки стран Европы, Азии, Африки и выпущенный общим тиражом свыше 5 миллионов экземпляров.
При изготовлении файла, использован сайт http://alnam.ru/book_chem.php
Общая химия - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
Большую роль играют хелатные соединения и в природе. Так, гемоглобин состоит из комплекса — гема, связанного с белком — глобином. В геме центральным ионом является ион Fe 2+, вокруг которого координированы четыре атома азота, принадлежащие к сложному лиганду с циклическими группировками. Гемоглобин обратимо присоединяет кислород и доставляет его из легких по кровеносной системе ко всем тканям. Хлорофилл, участвующий в процессах фотосинтеза в растениях, построен аналогично, но в качестве центрального иона содержит Mg 2+.
Все перечисленные классы комплексных соединений содержат один центральный атом, т. е. являются одноядерными. Встречаются комплексы и более сложной структуры, содержащие два или несколько центральных атомов одного и того же или разных элементов. Эти комплексы называются поли(много)ядерными.
Существуют различные типы полиядерных комплексов.
Комплексы с мостиковыми атомами или группами атомов, например с мостиковыми атомами хлора 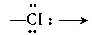 (хлоро-), кислорода
(хлоро-), кислорода 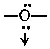 (оксо-), с мостиковыми группами
(оксо-), с мостиковыми группами 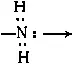 (амино),
(амино), 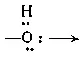 (гидроксо). Так, комплекс [Cr(NH 3) 5-OH→(NH 3) 5Cr]Cl 5является биядерным комплексом с одной мостиковой гидроксогруппой. К подобным соединениям относится и димер Al 2Cl 6(см. стр. 615).
(гидроксо). Так, комплекс [Cr(NH 3) 5-OH→(NH 3) 5Cr]Cl 5является биядерным комплексом с одной мостиковой гидроксогруппой. К подобным соединениям относится и димер Al 2Cl 6(см. стр. 615).
Комплексы кластерного типа, в которых атомы металла непосредственно связаны друг с другом. Это наблюдается, например, в димерах (CO) 5Mn-Mn(CO) 5, [Re 2H 2Cl 8] 2-. В последнем соединении между атомами рения имеется тронная связь:
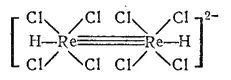
К многоядерным соединениям относятся также изополикислоты.
Изополикислоты образуются при соединении двух или нескольких кислотных остатков одной и той же кислородной кислоты за счет кислородных мостиков. В их число входят двухромовая H 2CrO 7, пирофосфорная H 4P 2O 7, тетраборная H 2B 4O 7кислоты, а также поликремниевые кислоты, составляющие основу силикатов.
- 571 -
Гетерополикислоты содержат не менее двух различных кислот или оксидов (производных неметалла и металла) и большое количество воды (до 30 молекул). Наиболее важное значение в аналитической химии имеют следующие гетерополикпслоты:
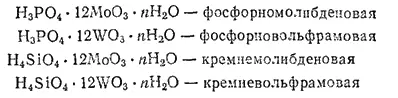
Известно немного комплексов, в которых центром координации является акнон, — это полигалогениды, содержащие анионы [I·xI 2] -(где x меняется от 1 до 4) или [Br·xBr 2] -(где x 1 или 2); существуют и смешанные полигалогенидные анионы — [I·xBr 2] -, [I·xCl 2] -. Большую роль при их образовании играет поляризация: чем больше интенсивность поляризационного взаимодействия между анионом Э -и молекулой Э 2, тем устойчивее комплекс. Именно поэтому наиболее устойчивыми из них оказываются полииодиды (молекулы 12 легко поляризуются), а полифториды не получены. Вследствие наличия в растворе равновесия
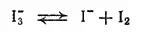
раствор полииодида обнаруживает свойства свободного иода.
Существует много способов образования названий комплексных соединений, в том числе и традиция называть их по фамилиям исследователей, их открывших. Такой способ, хотя и отдает дань уважения ученым, сложен для запоминания. Мы приведем номенклатуру главнейших типов комплексных соединений, основанную на рекомендациях Международного союза теоретической и прикладной химии.
Название комплексного аниона начинают с указания состава внутренней сферы.
Во внутренней сфере, прежде всего называют анионы, прибавляя к их латинскому названию окончание "o". Например: Cl -- хлоро, CN -— циано, SO 3 2-— сульфито, OH -— гидрэксо и т. д. Далее называют нейтральные лиганды. При этом пользуются терминами: для координированного аммиака — аммин, для воды — аква. Число лигандов указывают греческими числительными: 1 — моно (часто не приводится), 2 — ди, 3 — три, 4 — тетра, 5 — пента, 6 — гекса. Затем называют комплексообразователь, используя корень его латинского названия и окончание ат, после чего римскими цифрами указывают (в скобках) степень окисленности комплексообразователя. После обозначения состава внутренней сферы называют внешнесферные катионы. В случае неэлектролитов степень окисленности центрального атома не приводят, так как она однозначно определяется, исходя из электронейтральности комплекса.
- 572 -
Если центральный атом входит в состав катиона, то используют русское название элемента и в скобках указывают его степень окисленности. Приведем примеры:

205. Пространственное строение и изомерия комплексных соединений.
Одинаковые лиганды симметрично располагаются в пространстве вокруг центрального атома. Чаще встречаются четные координационные числа — 2, 4, 6. Им соответствуют следующие геометрические конфигурации:
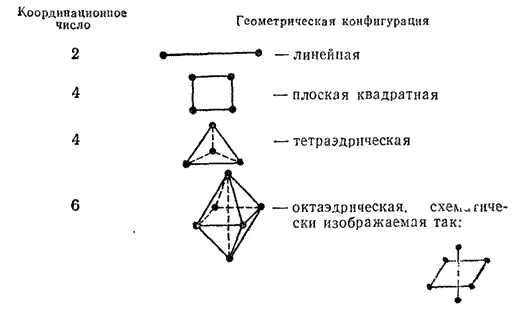
Впервые правильные представления о пространственном строении комплексных соединений были сформулированы А. Вернером. При этом он исходил из найденного опытным путем числа изомеров при наличии двух или более различных лигандов в комплексе и сравнивал его с возможным числом для той или иной предполагаемой конфигурации. Так, для координационного числа 4 и тетраэдрической конфигурации все положения лигандов относительно центрального атома эквивалентны.
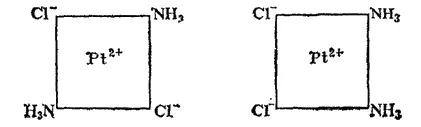
Рис. 156. Пространственное строение изомеров [Pt(NH 3) 2Cl 2]: слева — транс-изомер; справа - цис-изомер.
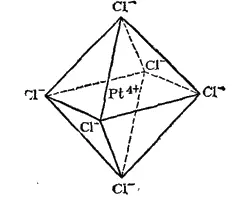
Рис. 157. Пространственное строение комплексного иона [PtCl 6] 2-.
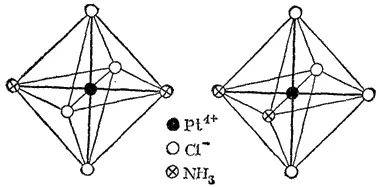
Рис. 158. Пространственное строение изомеров [Pt(NH 3) 2Cl 4]: слева — транс-изомер; справа — цис-изомер.
Поэтому тетраэдрические комплексы типа [MA 2B 2](где М — центральный атом, а А и В — лиганды) не имеют изомеров. Другое наблюдается в комплексах платины (II); например, [Pt(NH 3) 2Cl 2] встречается в двух изомерных формах, отличающихся по цвету, растворимости, дипольному моменту, реакционной способности и способам получения. Отсюда был сделан вывод о расположении лигандов по квадрату вокруг центрального атома, так как именно для этой конфигурации у соединений типа [MA 2B 2] должно иметься два изомера. В одном из изомеров комплекса [Pt(NH 3) 2Cl 2] атомы хлора разделены центральным атомом (транс-изомер), а в другом (цис-изомер) они находятся рядом друг с другом, по одну сторону от центрального атома (рис. 156).
Читать дальшеИнтервал:
Закладка:








