Николай Глинка - Общая химия
- Название:Общая химия
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Николай Глинка - Общая химия краткое содержание
Учебное пособие предназначено для студентов нехимических специальностей высших учебных заведений. Оно может служить пособием для лиц, самостоятельно изучающих основы химии, и для учащихся химических техникумов и старших классов средней школы.
Легендарный учебник, переведенный на многие языки стран Европы, Азии, Африки и выпущенный общим тиражом свыше 5 миллионов экземпляров.
При изготовлении файла, использован сайт http://alnam.ru/book_chem.php
Общая химия - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
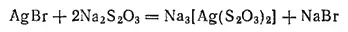
Далее негатив накладывают на фотобумагу и подвергают действию света — «печатают». При этом наиболее освещенными оказываются те места фотобумаги, которые находятся против светлых мест негатива. Поэтому в ходе печатания соотношение между светом и тенью меняется на обратное и становится отвечающим сфотографированному объекту. Это — позитивное изображение.
Ионы серебра подавляют развитие бактерий и уже в очень низкой концентрации (около 10 -10моль/л) стерилизуют питьевую воду. В медицине для дезинфекции слизистых оболочек применяются стабилизированные специальными добавками коллоидные растворы серебра (протаргол, колларгол и др.).
202. Золото (Aurum).
Золото встречается в природе почти исключительно в самородном состоянии, главным образом в виде мелких зерен, вкрапленных в кварц или содержащихся в кварцевом песке. В небольших количествах золото встречается в сульфидных рудах железа, свинца и меди. Следы его открыты в морской воде.
- 562 -
Общее содержание золота в земной коре составляет всего 5·10 -7% (масс.).
В СССР месторождения золота находятся в Сибири и на Урале. Крупные месторождения золота имеются в Южной Африке, на Аляске, в Канаде и Австралии.
Золото отделяется от песка и измельченной кварцевой породы промыванием водой, которая уносит частицы песка, как более легкие, или обработкой песка жидкостями, растворяющими золото. Чаще всего применяется раствор цианида натрия NaCN, в котором золото растворяется в присутствии кислорода с образованием комплексных анионов [Au(CN) 2] -:
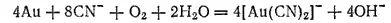
Из полученного раствора золото выделяют цинком:
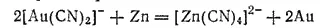
Осажденное золото обрабатывают для отделения от него цинка разбавленной серной кислотой, промывают и высушивают. Дальнейшая очистка золота от примесей (главным образом от серебра) производится обработкой его горячей концентрированной серной кислотой или путем электролиза.
Метод извлечения золота из руд с помощью растворов цианидов калия или натрия был разработан в 1843 г. русским инженером П. Р. Багратионом. Этот метод, принадлежащий к гидрометаллургическим способам получения металлов, в настоящее время наиболее распространен в металлургии золота.
Золото — ярко-желтый блестящий металл. Оно очень ковко и пластично; путем прокатки из него можно получить листочки толщиной менее 0,0002 мм, а из 1 г. золота можно вытянуть проволоку длиной 3,5 км. Золото — прекрасный проводник теплоты и электрического тока, уступающий в этом отношении только серебру и меди.
Ввиду мягкости золото употребляется в сплавах, обычно с серебром или медью. Эти сплавы применяются для электрических контактов, для зубопротезирования, в ювелирном деле.
В химическом отношении золото — малоактивный металл. На воздухе оно не изменяется, даже при сильном нагревании. Кислоты в отдельности не действуют на золото, но в смеси соляной и азотной кислот (царской водке) золото легко растворяется. Так же легко растворяется золото в хлорной воде и в аэрируемых (продуваемых воздухом) растворах цианидов щелочных металлов. Ртуть тоже растворяет золото, образуя амальгаму, которая при содержании более 15% золота становится твердой.
Известны два ряда соединений золота, отвечающие степеням окисленности +1 и +3.
Так, золото образует два оксида — оксид золота(I), или закись золота, Au 2O и оксид золота (III), или окись золота, Au 2O 3.
- 563 -
Более устойчивы соединения, в которых золото имеет степень окисленности +3.
При растворении золота в царской водке получается комплексная тетралхлорозолотая, или золотохлористоводородная, кислота H[AuCl 4], которая кристаллизуется в виде светло-желтых игл состава H[AuCl 4]·4H 2O (обычный продажный препарат золота). Известны хорошо кристаллизующиеся соли этой кислоты, например Na[AuCl 4], в растворах которых золото находится в виде комплексного аниона [AuCl 4] -.
Если осторожно нагревать тетрахлорозолотую кислоту, то она разлагается с выделением HCl и красновато-коричневых кристаллов хлорида AuCl 3.
Щелочи осаждают из растворов тетрахлорозолотой кислоты бурый гидроксид золота (III) Au(OH) 3, называемый также золотой кислотой, так как это вещество обладает слабокислотными свойствами и образует соли. При 100°C золотая кислота теряет воду, превращаясь в бурый оксид золота (III) Au 2O 3.
При нагревании хлорида золота (III) в струе диоксида углерода до 180°C получается хлорид золота (I) AuCl в виде белого малорастворимого в воде вещества. Из растворов хлорида золота (I) щелочи осаждают фиолетовый оксид золота (I) Au 2O.
Все соединения золота легко разлагаются при нагревании с выделением металлического золота,
Глава XVIII. КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
Знакомясь с элементами подгруппы меди, мы видели, что ионы этих элементов способны присоединять к себе другие ионы или нейтральные молекулы (например, NH 3), образуя более сложные комплексные ионы. При связывании последних ионами противоположного знака получаются различные комплексные соединения.
Комплексные соединения составляют наиболее обширный и разнообразный класс неорганических веществ. К ним принадлежат также многие металлорганические соединения (см. § 163), связывающие воедино ранее разобщенные неорганическую химию и органическую химию. Многие комплексные соединения — витамин B 12, гемоглобин, хлорофилл и другие — играют большую роль в физиологических и биохимических процессах. Исследование свойств и пространственного строения комплексных соединений оказалось чрезвычайно плодотворным для кристаллохимии, изучающей зависимость физико-химических свойств веществ от структуры образуемых ими кристаллов, и породило новые представления о природе химической связи. К ценным результатам привело применение комплексных соединений и в аналитической химии.
- 564 -
Не будет лишним сказать, что успехи теоретической и прикладной химии за последние годы во многом связаны именно с изучением комплексных соединений.
Наиболее удачно свойства и строение комплексных соединений объясняет координационная теория, предложенная в 1893 г. А. Вернером.
Альфред Вернер — швейцарский химик, лауреат Нобелевской премии, один из создателей учения о комплексных соединениях. Научная деятельность Вернера протекала в Цюрихском университете, профессором которого он был с 1893 г. Вернер синтезировал большое число новых комплексных соединений, систематизировал ранее известные и вновь полученные комплексные соединения и разработал экспериментальные методы доказательства их строения. Для объяснения строения и свойств комплексных соединений Вернер выдвинул идею о координации, т. е. о пространственном окружении иона металла анионами или нейтральными молекулами. Координационная теория легла в основу современных представлений о комплексных соединениях.
Читать дальшеИнтервал:
Закладка:








