Николай Глинка - Общая химия
- Название:Общая химия
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Николай Глинка - Общая химия краткое содержание
Учебное пособие предназначено для студентов нехимических специальностей высших учебных заведений. Оно может служить пособием для лиц, самостоятельно изучающих основы химии, и для учащихся химических техникумов и старших классов средней школы.
Легендарный учебник, переведенный на многие языки стран Европы, Азии, Африки и выпущенный общим тиражом свыше 5 миллионов экземпляров.
При изготовлении файла, использован сайт http://alnam.ru/book_chem.php
Общая химия - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
Такую же геометрическую конфигурацию (тетраэдр) имеют некоторые комплексы элементов подгруппы цинка, например [Zn(NH 3) 4]sp 2+, [Cd(NH 3) 4] 2+, [HgI 4] 2-. Так, в комплексе [Zn(NH 3) 4]sp 2+цинка предоставляет для электронных пар лигандов (условно показанных на схеме точками) одну 4s- и три 4p-орбитали

причем осуществляется sp 3-гибридизация, соответствующая размещению лигандов в вершинах тетраэдра (тетраэдрическая координация).
- 580 -
Ионы d-элементов с четырьмя занятыми d-орбиталями (Pt 2+, Pd 2+, Au 3+) при координационном числе 4 предоставляют для электронных пар лигандов одну (n-1)d-, одну ns- и две np-орбитали, например, в комплексе [Pt(NH 3) 4] 2+:
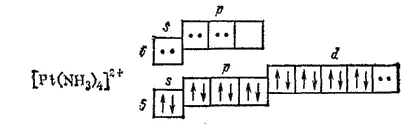
этом осуществляется гибридизация dsp 3, отвечающая размещению лигандов в вершинах квадрата (квадратная координация). Поэтому такие комплексы, как [Pt(NH 3) 4] 2+, [PtCl 4] 2-, обладают структурой плоского квадрата.
Координационному числу 6 соответствует гибридизация d 2sp 3и октаэдрическое расположение лигандов. Такая координация имеет место, например, в комплексах платины (IV):
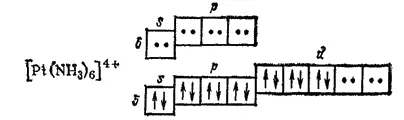
Такая же октаэдрическая координация осуществляется в комплексах [Co(NH 3) 6] 3+, [Fe(CH) 6] 4-, [RhCl 6] 3-и др.
Координационному числу 2 отвечает гибридизация sp-типа и линейная координация лигандов, например, в комплексе [Ag(NH 3) 2] +:
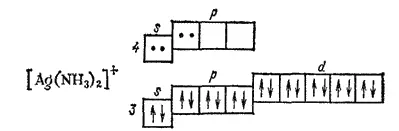
Рассмотренные примеры показывают, что метод ВС успешно объясняет определенные значения координационных чисел и геометрические формы комплексных частиц. Правильно описываются с позиций этого метода и различия в магнитных свойствах (диамагнитность или парамагнитность) комплексных соединений. Однако некоторые их свойства (например, спектры поглощения) не находят с позиций метода ВС удовлетворительного объяснения. Кроме того, взаимодействие между центральным атомом и лигандами в комплексных соединениях не сводится только к передаче электронов от лиганда.
- 581 -
Существуют лиганды, которые способны принимать электроны металла на вакантные орбитали, например на свободные d-орбитали (в молекуле PF 3или в ионе SnCl 3 -), или на незаполненные разрыхляющие орбитали (в молекулах C 2H 4, CO,NO).
Такие лиганды называют π-акцепторами, а связь их с центральным атомом π-дативной. Строение многих из открытых в последнее время комплексных соединений, например «сэндвичевых», нельзя объяснить с точки зрения метода ВС.
Метод молекулярных орбиталей. Молекулярные орбитали в комплексных соединениях образуются по тому же принципу и обладают теми же свойствами, что и молекулярные орбитали в двухатомных молекулах (см. § 45). Отличие заключается в том, что в комплексных соединениях МО являются многоцентровыми, делокализованными, подобно тому, что имеет место, например, в молекуле бензола (см. § 167).
Метод МО стал в настоящее время ведущим, наиболее плодотворным в теории строения комплексных соединений. В частности, он успешно объясняет строение и свойства уже упоминавшихся «сэндвичевых» соединений, например Cr(C 6H 6) 2, Fe(C 5H 5) 2, в которых центральный атом находится между циклическими органическими молекулами и связан с ними делокализованными многоцентровыми связями. Приложение метода МО к объяснению строения комплексных соединений рассматривается в специальных руководствах.
207. Диссоциация комплексных соединений в растворах.
Мы уже говорили о том, что внутренняя и внешняя сфера комплексного соединения сильно различаются по устойчивости; частицы, находящиеся во внешней сфере, связаны с комплексным ионом преимущественно электростатическими силами и легко отщепляются в водном растворе.
Эта диссоциация называется первичной, она протекает почти нацело, по типу диссоциации сильных электролитов. Лиганды, находящиеся во внутренней сфере, связаны с центральным атомом значительно прочнее и отщепляются лишь в небольшой степени. Обратимый распад внутренней сферы комплексного соединения носит название вторичной диссоциации. Например, диссоциацию комплекса [Ag(NH 3) 2]Cl можно записать так:
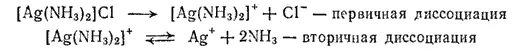
Вторичная диссоциация характеризуется наличием равновесия между комплексной частицей, центральным ионом и лигандами. В этом можно убедиться на основании следующих реакций. Если на раствор, содержащий комплексный ион [Ag(NH 3) 2] +, подействовать раствором какого-нибудь хлорида, то осадка не образуется, хотя из растворов обычных солей серебра при добавлении хлоридов выделяется осадок хлорида серебра.
- 582 -
Очевидно, концентрация ионов серебра в аммиачном растворе слишком мала, чтобы при введении в него даже избытка хлорид-ионов можно было бы достигнуть значения произведения растворимости хлорида серебра (ПР AgCl=1.8·10 -10). Однако после прибавления к раствору комплекса иодида калия выпадает осадок иодида серебра. Это доказывает, что ионы серебра все же имеются в растворе. Как ни мала их концентрация, но она оказывается достаточной для образования осадка, так как произведение растворимости иодида серебра AGI составляет только 1·10 -16, т. е. значительно меньше, чем у хлорида серебра. Точно так же при действии сероводорода получается осадок сульфида серебра Ag 2S, произведение растворимости которого равно 10 -51.
Уравнение протекающих реакций можно записать так:
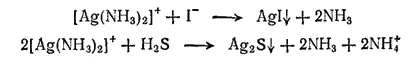
Диссоциация ионов [Ag(NH 3) 2] +, согласно приведенному выше уравнению, как и диссоциация всякого слабого электролита, подчиняется закону действия масс и может быть охарактеризована соответствующей константой равновесия, называемой константой нестойкости комплексного иона:
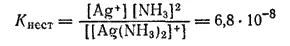
Константы нестойкости для различных комплексных ионов весьма различны и могут служить мерой устойчивости комплекса. Константы нестойкости, в выражения которых входят концентрации ионов и молекул, называются «концентрационными». Более строгими и не зависящими от концентраций и ионной силы раствора являются константы нестойкости, содержащие вместо концентраций активности ионов и молекул. В разбавленных растворах эти два различных выражения констант нестойкости совпадают друг с другом,
Читать дальшеИнтервал:
Закладка:








