Николай Глинка - Общая химия
- Название:Общая химия
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Николай Глинка - Общая химия краткое содержание
Учебное пособие предназначено для студентов нехимических специальностей высших учебных заведений. Оно может служить пособием для лиц, самостоятельно изучающих основы химии, и для учащихся химических техникумов и старших классов средней школы.
Легендарный учебник, переведенный на многие языки стран Европы, Азии, Африки и выпущенный общим тиражом свыше 5 миллионов экземпляров.
При изготовлении файла, использован сайт http://alnam.ru/book_chem.php
Общая химия - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
Из приведенной формулы видно, что чем меньше концентрация продуктов распада, т. е. чем устойчивее комплекс, тем меньше его константа нестойкости. Наиболее устойчивые в растворах комплексные частицы имеют наименьшие константы нестойкости. Так, среди однотипных соединений

устойчивость комплекса возрастает при переходе от [Ag(NO 2) 2] -к [Ag(CN) 2] -. Ион [Ag(CN) 2] -настолько стоек, что даже прибавление иодида калия к раствору комплексной соли не приводит к образованию осадка иодида серебра. Но при действии сероводорода, ввиду ничтожно малого значения произведения растворимости сульфида серебра, все же выпадает осадок сульфида серебра.
- 583 -
В последнее время для характеристики устойчивости комплексных соединений предпочитают пользоваться величиной, обратной константе нестойкости, называемой константой устойчивости. Для иона [Ag(NH 3) 2] +константа устойчивости равна:
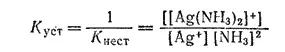
До сих пор шла речь об общих константах нестойкости и устойчивости, относящихся к распаду комплекса на конечные продукты. В действительности же в растворах имеет место ступенчатая диссоциация комплекса, аналогично ступенчатой диссоциации слабых электролитов, например многоосновных кислот.
Так, в водном растворе K 2[PtCl 4] присутствуют в различных соотношениях все комплексы, участвующие в равновесиях:

Каждое из этих равновесий характеризуется своей ступенчатой константой нестойкости K 4, K 3и т. д. По мере отщепления хлорид-ионов заряд комплекса становится все более положительным, а число ионов Cl- в комплексе уменьшается. В результате последовательный отрыв хлорид-ионов все в большей степени затрудняется. Поэтому между ступенчатыми константами нестойкости иона [PtCl 4] 2-имеет место соотношение: K 4>K 3>K 2>K 1.
Такое изменение в значениях последовательных констант нестойкости носит общий характер*. Значение общей константы нестойкости равно произведению всех ступенчатых констант.
Значения констант нестойкости и устойчивости приводятся в справочниках по химии. С помощью этих величин можно предсказать течение реакций между комплексными соединениями: при сильном различии констант устойчивости реакция пойдет в сторону образования комплекса с большей константой устойчивости или, что равноценно, с меньшей константой нестойкости. Например, для иона [Ag(NH 3) 2] +K нест= 6,8·10 -8, а для иона NH 4 +K нест= 5,4·10 -1поэтому под действием кислот аммиакат серебра разрушается с образованием ионов Ag+ и NH 4 +:
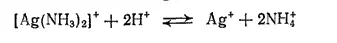
- 584 -
Комплекс же [Pt(NH 3) 4] 2+(K нест= 5·10 -34) не разрушается при комнатной температуре даже в концентрированной соляной кислоте.
Процессы комплексообразования широко используются в аналитической химии. При выборе условий наиболее эффективного разделения ионов исходят из соотношения констант устойчивости образуемых ими комплексных соединений.
Например, катионы Ni 2+, Co 2+, Zn 2+дают устойчивые растворимые аммиакаты, а Al 3+, Fe 3+, Cr 3+менее склонны к комплексообразованию с аммиаком и осаждаются при действии аммиака в виде гидроксидов. Это позволяет разделить действием аммиака эти две группы катионов. Подобного рода соображения могут быть использованы для разделения анионов: так, можно осадить смесь хлоридов и иодидов в виде AgCl и AgI и далее обработать ее аммиаком — в раствор перейдет только AgCl, а AgI останется в осадке. Для того чтобы растворить AgI, нужно применить лиганд, связывающий Ag+ значительно прочнее, например CN-, так как для комплекса [Ag(CN) 2] -K нест= 1·10 -21. В растворе KCN иодид серебра растворяется с образованием K[Ag(CN) 2]:

Константы устойчивости однотипных комплексов зависят от ряда факторов, и прежде всего от природы центрального атома и лигандов. В комплексах с центральными ионами, обладающими слабой поляризующей способностью, например с ионами щелочных и щелочноземельных металлов, устойчивость растет по мере увеличения интенсивности электростатического взаимодействия между центральным ионом и лигандами: чем больше заряды центрального иона и лигандов и чем меньше их радиусы, тем выше устойчивость комплексов. Эти катионы образуют более устойчивые комплексы с лигандами, содержащими элементы малых периодов (кислород, азот) и с ионами F-.
Для другой большой группы комплексообразователей — катионов платиновых металлов, ионов Hg 2+, Ag +, Au 3+, у которых поляризующая способность выражена сильно и характер связи центрального атома с лигандами приближается к ковалентному, — наиболее устойчивы комплексы с легко поляризующимися лигандами. К последним относятся, например, ионы I- и лиганды, содержащие атомы Р и S.
208. Влияние координации на свойства лигандов и центрального атома.
Взаимное влияние лигандов. Координация сопряжена с изменением электронной конфигурации лнгандов и в результате приводит к изменению их свойств. Это хорошо видно на примере кислотноосновных свойств комплексных соединений. В то время как свободный аммиак обладает в водном растворе основными свойствами, комплекс [Pt(NH 3) 6] 4+проявляет свойства кислоты и вступает в обратимую реакцию со щелочью:
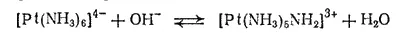
Причина изменения свойств аммиака заключается в том, что при его координации происходит смещение электронной плотности к положительно заряженному центральному атому.
- 585 -
В результате эффективный отрицательный заряд атома азота в молекуле NH 3резко снижается, что и облегчает отщепление протона.
Аналогично ведут себя в поле катионов некоторых переходных металлов и другие полярные или легко поляризующиеся молекулы, способные проявлять протонодонорные свойства — H 2Oб NH 2OH , органические амины. Выступая в качестве лигандов, они способны к отщеплению протона в водных растворах и с точки зрения протонной теории кислот и оснований (стр. 237) ведут себя как кислоты. Например, взаимодействие гидратированного иона меди с водой следует записать так:
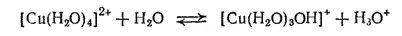
Интервал:
Закладка:








