Николай Глинка - Общая химия
- Название:Общая химия
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Николай Глинка - Общая химия краткое содержание
Учебное пособие предназначено для студентов нехимических специальностей высших учебных заведений. Оно может служить пособием для лиц, самостоятельно изучающих основы химии, и для учащихся химических техникумов и старших классов средней школы.
Легендарный учебник, переведенный на многие языки стран Европы, Азии, Африки и выпущенный общим тиражом свыше 5 миллионов экземпляров.
При изготовлении файла, использован сайт http://alnam.ru/book_chem.php
Общая химия - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
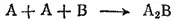
Тогда в соответствии с законом действия масс можно записать:
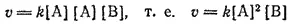
Как видно, в этом случае концентрация каждого из реагирующих веществ входит в выражение скорости реакции в степени, равной соответствующему коэффициенту в уравнении реакции.
Вероятность одновременного столкновения более чем трех частиц крайне мала. Поэтому сложные реакции, уравнения которых содержат большое число частиц, представляют собой совокупность последовательно или параллельно протекающих процессов, каждый из которых происходит, как правило, при столкновении двух частиц или в результате распада отдельной частицы. В подобных случаях закон действия масс применим только к каждой отдельной стадии реакции, но не к реакции в целом.
Величина константы скорости k зависит от природы реагирующих веществ, от температуры и от присутствия катализаторов, но не зависит от концентраций веществ.
В качестве примера приложения закона действия масс можно привести уравнение зависимости скорости реакции окисления оксида азота (II)
2NO + O 2= 2NO 2
от концентраций NO и O 2:
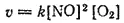
В случае гетерогенных реакций в уравнения закона действия масс входят концентрации только тех веществ, которые находятся в газовой фазе или в растворе. Концентрация вещества, находящегося в твердой фазе, обычно представляет собой постоянную величину и поэтому входит в константу скорости. Например, для реакции горения угля
C+O 2=CO 2
закон действия масс запишется так:
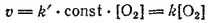
где k=k'*const.
59. Зависимость скорости реакции от температуры и от природы реагирующих веществ.
Молекулярно-кинетическая теория газов и жидкостей дает возможность подсчитать число соударений между молекулами тех или иных веществ при определенных условиях.
- 167 -
Если воспользоваться результатами таких подсчетов, то окажется, что число столкновений между молекулами веществ при обычных условиях столь велико, что все реакции должны протекать практически мгновенно. Однако в действительности далеко не все реакции заканчиваются быстро. Это противоречие можно объяснить, если предположить, что не всякое столкновение молекул реагирующих веществ приводит к образованию продукта реакции. Для того чтобы произошла реакция, т. е. чтобы образовались новые молекулы, необходимо сначала разорвать или ослабить связи между атомами в молекулах исходных веществ. На это надо затратить определенную энергию. Если сталкивающиеся молекулы не обладают такой энергией, то столкновение будет неэффективным— не приведет к образованию новой молекулы. Если же кинетическая энергия сталкивающихся молекул достаточна для ослабления или разрыва связей, то столкновение может привести к перестройке атомов и к образованию молекулы нового вещества.
Избыточная энергия, которой должны обладать молекулы для того, чтобы их столкновение могло привести к образованию нового вещества, называется энергией активации данной реакции. Энергию активации выражают в кДж/моль. Молекулы, обладающие такой энергией, называются активными молекулами.
С ростом температуры число активных молекул возрастает. Отсюда следует, что и скорость химической реакции должна увеличиваться с повышением температуры. Действительно, при возрастании температуры химические реакции протекают быстрее.
Для того чтобы лучше понять ускоряющее действие температуры на химические реакции, рассмотрим, как распределяются молекулы вещества по величине их энергии. В качестве примера на рис. 63 показано такое распределение для газа, находящегося при постоянной температуре. По горизонтальной оси отложена энергия Е одной молекулы газа, а по вертикальной- доля общего числа молекул, обладающих энергией, лежащей в узком интервале от Е до E + ΔE , деленная на величину этого интервала ΔE. Если общее число молекул газа обозначать через N, а их долю, обладающую энергией, лежащей в указанном интервале, через ΔN/N, то откладываемая по оси ординат величина будет равна ΔN/(NΔE).
Рассмотрим столбик шириной ΔE и высотой, равной ординате кривой (см. рис. 63). Площадь такого столбика будет равна ΔE·ΔN/(NΔE)=ΔN/N, т. е. доле молекул, энергия которых лежит в интервале ΔE. Аналогично площадь, ограниченная кривой, двумя ординатами (например, ординатами, отвечающими значениям энергии E 1и E 2) и осью абсцисс (участок E 1ABE 2на рис. 63), равна доле молекул газа, энергия которых лежит в данном промежутке- в нашем случае в промежутке от E 1до E 2. Точно так же площадь, лежащая под кривой и ограниченная слева ординатой (например, ординатой, отвечающей E 3), равна доле молекул, энергия которых превышает значение E 3(участок на рис. 63, покрытый сеткой).
Площадь, ограниченная всей кривой и осью абсцисс, равна единице.
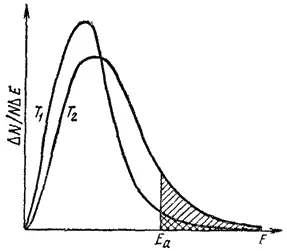
Рис. 63. Распределение молекул газа по кинетической энергии. Площадь участка E 1ABE 2равна доле молекул, энергия которых находится в интервале от E 1до E 2. Площадь участка, покрытого сеткой, равна доле молекул, энергия которых превышает E 3.
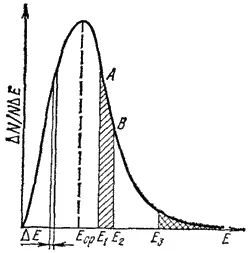
Рис. 64. Распределение молекул газа по кинетической энергии для двух температур T 1и T 2(T 2> T 1)
E 2- энергия активации. Площади заштрихованных участков выражают доли активных молекул при температурах T 1и T 2.
- 168 -
Кривая на рис. 63 показывает, что молекулы газа, находящегося при постоянной температуре, обладают различной энергией. Наибольшая часть их имеет энергию, равную некоторой средней величине E срили близкую к ней. Но имеются молекулы, энергия которых больше или меньше E ср. При этом, чем сильнее отличается энергия от E ср, т. е. чем дальше от максимума расположена точка кривой, тем меньшая доля молекул газа обладает такой энергией.
Как изменится кривая при изменении температуры? На рис. 64 показаны две кривые, отвечающие одному и тому же количеству газа, находящегося при температуре T 1и T 2(T 2> T 1). Видно, что кривая, относящаяся к температуре T 2, смещена вправо — в сторону более высоких энергий.
Если на рис. 64 отметить энергию активации E aкакой-либо реакции, протекающей с участием данного газа, то будет видно, что доля молекул газа, энергия которых превышает E a, резко возрастает с повышением температуры.
Читать дальшеИнтервал:
Закладка:








