Николай Глинка - Общая химия
- Название:Общая химия
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Николай Глинка - Общая химия краткое содержание
Учебное пособие предназначено для студентов нехимических специальностей высших учебных заведений. Оно может служить пособием для лиц, самостоятельно изучающих основы химии, и для учащихся химических техникумов и старших классов средней школы.
Легендарный учебник, переведенный на многие языки стран Европы, Азии, Африки и выпущенный общим тиражом свыше 5 миллионов экземпляров.
При изготовлении файла, использован сайт http://alnam.ru/book_chem.php
Общая химия - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
Знание скоростей химических реакций имеет очень большое научное и практическое значение. Например, в химической промышленности при производстве того или иного вещества от скорости реакции зависят размеры и производительность аппаратуры, количество вырабатываемого продукта.
При рассмотрении вопроса о скорости реакции необходимо различать реакции, протекающие в гомогенной системе (гомогенные реакции), и реакции, протекающие в гетерогенной системе (гетерогенные реакции).
Системой в химии принято называть рассматриваемое вещество или совокупность веществ. При этом системе противопоставляется внешняя среда — вещества, окружающие систему. Обычно система физически отграничена от среды.
Различают гомогенные и гетерогенные системы. Гомогенной называется система, состоящая из одной фазы, гетерогенной — система, состоящая из нескольких фаз. Фазой называется часть системы, отделенная от других ее частей поверхностью раздела, при переходе через которую свойства изменяются скачком.
Примером гомогенной системы может служить любая газовая смесь (все газы при не очень высоких давлениях неограниченно растворяются друг в друге), хотя бы смесь азота с кислородом. Другим примером гомогенной системы может служить раствор нескольких веществ в одном растворителе, например раствор хлорида натрия, сульфата магния, азота и кислорода в воде. В каждом из этих двух случаев система состоит только из одной фаз: из газовой фазы в первом примере и из водного раствора во втором.
- 164 -
В качестве примеров гетерогенных систем можно привести следующие системы: вода со льдом, насыщенный раствор с осадком, уголь и сера в атмосфере воздуха. В последнем случае система состоит из трех фаз: двух твердых и одной газовой.
Если реакция протекает в гомогенной системе, то она идет во всем объеме этой системы. Например, при сливании (и перемешивании) растворов серной кислоты и тиосульфата натрия помутнение, вызываемое появлением серы, наблюдается во всем объеме раствора:
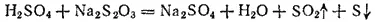
Если реакция протекает между веществами, образующими гетерогенную систему, то она может идти только на поверхности раздела фаз, образующих систему. Например, растворение металла в кислоте
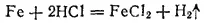
может протекать только на поверхности металла, потому что только здесь соприкасаются друг с другом оба реагирующих вещества. В связи с этим скорость гомогенной реакции и скорость гетерогенной реакции определяются различно.
Скоростью гомогенной реакции называется количество вещества, вступающего в реакцию или образующегося при реакции за единицу времени в единице объема системы.
Скоростью гетерогенной реакции называется количество вещества, вступающего в реакцию или образующегося при реакции за единицу времени на единице площади поверхности фазы*.
Оба эти определения можно записать в математической форме. Введем обозначения: v гомог- скорость реакции в гомогенной системе; v гетерог— скорость реакции в гетерогенной системе; n — число молей какого-либо из получающихся при реакции веществ; V-объем системы; t — время; S — площадь поверхности фазы, на которой протекает реакция; Δ — знак приращения (Δn=n 2- n 1; Δt=t 2- t 1). Тогда:
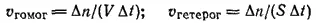
Первое из этих уравнений можно упростить. Отношение количества вещества (n) к объему (V) системы представляет собою молярную концентрацию (С) данного вещества: n/V=C , откуда Δn/V=ΔC и окончательно:
v гомог= ΔC/Δt
* Площадь поверхности твердого тела не всегда легко измерить. поэтому иногда скорость гетерогенной реакции относят не к единице площади поверхности, а к единице массы или объема твердой фазы.
- 165 -
Последнее уравнение является математическим выражением другого определения скорости реакции в гомогенной системе: скоростью реакции в гомогенной системе называется изменение концентрации какого-либо из веществ, вступающих в реакцию или образующихся при реакции, происходящее за единицу времени.
Как уже говорилось, при практическом использовании химических реакций весьма важно знать, с какой скоростью будет протекать данная реакция в тех или иных условиях, и как нужно изменить эти условия для того, чтобы реакция протекала с требуемой скоростью. Раздел химии, изучающий скорости химических реакций, называется химической кинетикой.
К важнейшим факторам, влияющим на скорость реакции, относятся следующие: природа реагирующих веществ, их концентрации, температура, присутствие в системе катализаторов. Скорость некоторых гетерогенных реакций зависит также от интенсивности движения жидкости или газа около поверхности, на которой происходит реакция.
58. Зависимость скорости реакции от концентраций реагирующих веществ.
Необходимым условием того, чтобы между частицами (молекулами, ионами) исходных веществ произошло химическое взаимодействие, является их столкновение друг с другом (соударение). Точнее говоря, частицы должны сблизиться друг с другом настолько, чтобы атомы одной из них испытывали бы действие электрических полей, создаваемых атомами другой. Только при этом станут возможны те переходы электронов и перегруппировки атомов, в результате которых образуются молекулы новых веществ — продуктов реакции. Поэтому скорость реакции пропорциональна числу соударений, которые претерпевают молекулы реагирующих веществ.
Число соударений, в свою очередь, тем больше, чем выше концентрация каждого из исходных веществ или, что то же самое, чем больше произведение концентраций реагирующих веществ. Так, скорость реакции
A+B=C
пропорциональна произведению концентрации вещества А на концентрацию вещества В. Обозначая концентрации веществ А и В соответственно через [A] и [B] , можно написать
v=k[A][B]
где k — коэффициент пропорциональности, называемый константой скорости данной реакции.
Полученное соотношение выражает закон действия масс для химической реакции, протекающей при столкновении двух частиц: при постоянной температуре скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ. Этот закон открыт опытным путем К. Гульдбергом и П. Вааге (Норвегия) в 1867 г.
Гораздо реже реакция осуществляется в результате одновременного столкновения трех реагирующих частиц. Например, реакция типа
2A + B = A 2B
может протекать путем тройного столкновения:
Читать дальшеИнтервал:
Закладка:








