Николай Глинка - Общая химия
- Название:Общая химия
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Николай Глинка - Общая химия краткое содержание
Учебное пособие предназначено для студентов нехимических специальностей высших учебных заведений. Оно может служить пособием для лиц, самостоятельно изучающих основы химии, и для учащихся химических техникумов и старших классов средней школы.
Легендарный учебник, переведенный на многие языки стран Европы, Азии, Африки и выпущенный общим тиражом свыше 5 миллионов экземпляров.
При изготовлении файла, использован сайт http://alnam.ru/book_chem.php
Общая химия - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
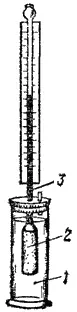
Рис. 77. Схема прибера для измерения осмотического давления: 1 — сосуд с содой; 2 — сосуд с полупроницаемыми стенками; 3 — трубка.
Обработанный таким образом цилиндр обладает свойствами полупроницаемой перегородки; через его стенки могут проходить молекулы воды, но для молекул растворенного вещества они непроницаемы.
Если в такой цилиндр налить раствор какого-либо вещества, например, сахара, и погрузить цилиндр в воду, то выравнивание концентраций будет происходить только вследствие перемещения молекул воды. Последние в большем числе диффундируют в раствор, чем обратно, поэтому объем раствора будет постепенно увеличиваться, а концентрация сахара в нем уменьшаться. Такая односторонняя диффузия через полупроницаемую перегородку называется осмосом.
Возьмем сосуд 2 с полупроницаемыми стенками, переходящий вверху в узкую вертикальную трубку 3 (рис. 77). Наполним его раствором сахара и погрузим в сосуд 1 с водой. Вследствие осмоса объем раствора будет постепенно увеличиваться и раствор начнет заполнять вертикальную трубку. По мере поднятия уровня раствора в трубке будет создаваться избыточное давление водяного столба (гидростатическое давление), измеряемое разностью уровней жидкости и противодействующее проникновению молекул воды в раствор. Когда гидростатическое давление достигнет определенной величины, осмос прекратится — наступит равновесие. Гидростатическое давление станет равным тому давлению, которое служит количественной характеристикой осмоса, — осмотическому давлению раствора. Измеряя гидростатическое давление при таком равновесии, можно тем самым определить величину осмотического давления.
Явления осмоса играют очень важную роль в жизни животных и растительных организмов. Оболочки клеток представляют собой перепонки, легко проницаемые для воды, но почти непроницаемые для веществ, растворенных во внутриклеточной жидкости. Проникая в клетки, вода создает в них избыточное давление, которое слегка растягивает оболочки клеток и поддерживает их в напряженном состоянии. Вот почему такие мягкие органы растения, как травянистые стебли, листья, лепестки цветов, обладают упругостью. Если срезать растение, то вследствие испарения воды объем внутриклеточной жидкости уменьшается, оболочки клеток опадают, становятся дряблыми — растение вянет.
- 218 -
Но стоит только начавшее вянуть растение поставить в воду, как начинается осмос, оболочки клеток снова напрягаются и растение принимает прежний вид.
Осмос является также одной из причин, обусловливающих поднятие воды по стеблю растения, питание клеток и многие другие явления.
При измерениях осмотического давления различных растворов было установлено, что величина осмотического давления зависит от концентрации раствора и от его температуры, но не зависит ни от природы растворенного вещества, ни от природы растворителя. В 1886 г. Вант-Гофф показал, что для растворов неэлектролитов невысоких концентраций зависимость осмотического давления от концентрации и температуры раствора выражается уравнением (закон Вант-Гоффа):
P = CRT
Здесь Р — осмотическое давление раствора, кПа; С — его молярная концентрация (молярность), моль/л; R — универсальная газовая постоянная, 8,314 Дж/(моль·К); Т — абсолютная температура раствора.
Молярность раствора С представляет собой отношение количества растворенного вещества n к объему раствора V (л)
C = n/V
а количество вещества равно его массе m, деленной на молярную массу М. Отсюда для молярности раствора получаем:
C = m/MV
Подставляя это значение С в уравнение Вант-Гоффа, найдем:
PV = mRT/M
Полученное уравнение по форме напоминает уравнение состояния идеального газа Клапейрона — Менделеева. Это уравнение позволяет по величине осмотического давления раствора определять молярную массу (а значит, и относительную молекулярную массу) растворенного вещества.
Пример. Осмотическое давление раствора, в 250 мл которого содержится 3 г. сахара, при 12°C равно 83,14 кПа. Определить относительную молекулярную массу сахара.
Подставляя данные в последнее уравнение, получаем
83,14·0,25 = 3·8,314(273+12)/M
откуда М=342 г/моль. Относительная молекулярная масса сахара равна 342.
- 219 -
Если к раствору, отделенному от воды полупроницаемой перегородкой, приложить внешнее давление, равное осмотическому давлению раствора, то, как уже говорилось, осмос прекратится.
Если же приложенное внешнее давление превысит осмотическое, то диффузия воды будет преимущественно происходить из раствора в водную фазу, т. е. в направлении, противоположном направлению переноса воды при осмосе. Такое явление получило название обратного осмоса.
В настоящее время обратный осмос начали применять как одни из наиболее экономичных способов опреснения воды. Солевом раствор (например, морскую воду) отделяют полупроницаемой мембраной от пресной воды и подвергают давлению более высокому, чем осмотическое давление раствора. В результате часть содержащейся в растворе воды «вытесняется» в фазу пресной воды, а концентрация солей в оставшемся растворе повышается. Концентрированный солевой раствор периодически заменяют свежими порциями подлежащей опреснению воды.
79. Давление пара растворов.
При данной температуре давление насыщенного пара над каждой жидкостью — величина постоянная. Опыт показывает, что при растворении в жидкости какого-либо вещества давление насыщенного пара этой жидкости понижается. Таким образом, давление насыщенного пара растворителя над раствором всегда ниже, чем над чистым растворителем при той же температуре. Разность между этими величинами принято называть понижением давления пара над раствором (или понижением давления пара раствора). Отношение величины этого понижения к давлению насыщенного пара над чистым растворителем называется относительным понижением давления пара над раствором.
Обозначим давление насыщенного пара растворителя над чистым растворителем через p 0, а над раствором через p. Тогда относительное понижение давления пара над раствором будет представлять собою дробь:
(p 0- p)/p 0
В 1887 г. французский физик Рауль, изучая растворы различных нелетучих жидкостей и веществ в твердом состоянии, установил закон, связывающий понижение давления пара над разбавленными растворами неэлектролитов с концентрацией:
Относительное понижение давления насыщенного пара растворителя над раствором равно молярной доле растворенного вещества.
Математическим выражением закона Рауля является уравнение:
Читать дальшеИнтервал:
Закладка:








