Николай Глинка - Общая химия
- Название:Общая химия
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Николай Глинка - Общая химия краткое содержание
Учебное пособие предназначено для студентов нехимических специальностей высших учебных заведений. Оно может служить пособием для лиц, самостоятельно изучающих основы химии, и для учащихся химических техникумов и старших классов средней школы.
Легендарный учебник, переведенный на многие языки стран Европы, Азии, Африки и выпущенный общим тиражом свыше 5 миллионов экземпляров.
При изготовлении файла, использован сайт http://alnam.ru/book_chem.php
Общая химия - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
Эти предположения в дальнейшем были развиты в стройную теорию, получившую название теории электролитической диссоциации. Согласно этой теории, при растворении в воде электролиты распадаются (диссоциируют) на положительно и отрицательно заряженные ионы. Положительно заряженные ионы называются катионами; к ним относятся, например, ионы водорода и металлов.
Отрицательно заряженные ионы называются анионами; к ним принадлежат ионы кислотных остатков и гидроксид-ионы. Как и молекулы растворителя, ионы в растворе находятся в состоянии неупорядоченного теплового движения.
Процесс электролитической диссоциации изображают, пользуясь химическими уравнениями. Например, диссоциация HCl выразится уравнением:
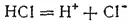
Распад электролитов на ионы объясняет отклонения от законов Вант-Гоффа и Рауля, о которых говорилось в начале этой главы. В качестве примера мы приводили понижение температуры замерзания раствора NaCl. Теперь нетрудно понять, почему понижение температуры замерзания этого раствора столь велико. Хлорид натрия переходит в раствор в виде ионов Na +и Cl -. При этом из одного моля NaCl получается не 6,02·10 23частиц, а вдвое большее их число. Поэтому и понижение температуры замерзания в растворе NaCl должно быть вдвое больше, чем в растворе неэлектролита той же концентрации.
Точно так же в очень разбавленном растворе хлорида бария, диссоциирующего согласно уравнению
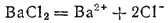
осмотическое давление оказывается в 3 раза больше, чем вычисленное по закону Вант-Гоффа, так как число частиц в растворе в 3 раза больше, чем если бы хлорид бария находился в нем в виде молекул BaCl 2.
Таким образом, особенности водных растворов электролитов, противоречащие с первого взгляда законам Вант-Гоффа и Рауля, были объяснены на основе этих же законов.
Однако теория Аррениуса не учитывала всей сложности явлений в растворах. В частности, она рассматривала ионы как свободные, независимые от молекул растворителя частицы. Теории Аррениуса противостояла химическая, или гидратная, теория растворов Менделеева, в основе которой лежало представление о взаимодействии растворенного вещества с растворителем. В преодолении кажущегося противоречия обеих теорий большая заслуга принадлежит русскому ученому И. А. Каблукову, впервые высказавшему предположение о гидратации ионов. Развитие этой идеи привело в дальнейшем к объединению теорий Аррениуса и Менделеева.
83. Процесс диссоциации.
В зависимости от структуры растворяющегося вещества в безводном состоянии его диссоциация протекает по-разному. Наиболее типичны при этом два случая.
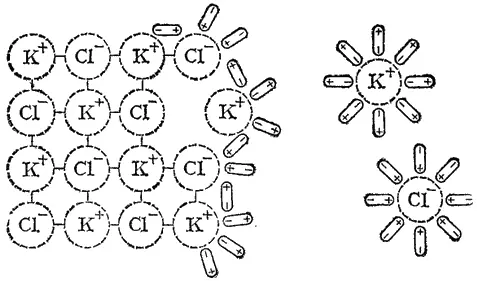
Рис. 80. Схема растворения соли.
Один из них — это диссоциация растворяющихся солей, т. е. кристаллов с ионной структурой, второй — диссоциация при растворении кислот, т. е. веществ, состоящих из полярных молекул.
Когда кристалл соли, например, хлорида калия, попадает в воду, то расположенные на его поверхности ионы притягивают к себе полярные молекулы воды (нон-диполькое взаимодействие). К ионам калия молекулы воды притягиваются своими отрицательными полюсами, а к хлорид-ионам — положительными (рис. 80). Но, если ионы притягивают к себе молекулы воды, то и молекулы воды с такой же силой притягивают к себе ионы. В то же время притянутые молекулы воды испытывают толчки со стороны других молекул, находящихся в движении. Этих толчков вместе с тепловыми колебаниями ионов в кристалле оказывается достаточно для отделения ионов от кристалла и перехода их в раствор. Вслед за первым слоем ионов в раствор переходит следующий слой, и таким образом идет постепенное растворение кристалла.
Иначе протекает диссоциация полярных молекул (рис. 81). Молекулы воды, притянувшиеся к концам полярной молекулы (диполь-дипольное взаимодействие), вызывают расхождение ее полюсов— поляризуют молекулу. Такая поляризация в сочетании с колебательным тепловым движением атомов в рассматриваемой молекуле, а также с непрерывным тепловым движением окружающих ее молекул воды приводит в конечном счете к распаду полярной молекулы на ионы. Как и в случае растворения ионного кристалла, эти ионы гидратируются.
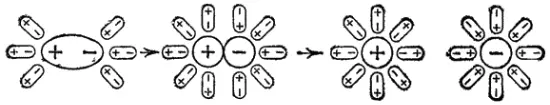
Рис. 81. Схема диссоциации полярных молекул в растворе.
- 228 -
При этом ион водорода H +(т. е. протон) оказывается прочно связанным с молекулой воды в ион гидроксония H 3O +. Так, при растворении в воде хлороводорода происходит процесс, который схематически можно выразить уравнением:
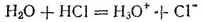
В результате этого процесса молекула HCl расщепляется таким образом, что общая пара электронов остается у атома хлора, который превращается в ион Cl -, а протон, внедряясь в электронную оболочку атома кислорода в молекуле воды, образует ион гидросония H 3O +.
Подобного же рода процессы происходят и при растворении в воде других кислот, например, азотной:
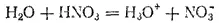
Перешедшие в раствор ионы остаются связанными с молекулами воды и образуют гидраты ионов. Иначе говоря, в результате диссоциации образуются не свободные ноны, а соединения ионов с молекулами растворителя. В общем случае любого растворителя эти соединения называются сольватами ионов. Но в уравнениях диссоциации обычно пишут формулы ионов, а не их гидратов или сольватов, тем более что число молекул растворителя, связанных с ионами, изменяется в зависимости от концентрации раствора и других условий.
Диссоциации веществ как ионного, так и молекулярного строения способствует полярность молекул растворителя. Поэтому не только вода, но и другие жидкости, состоящие из полярных молекул (муравьиная кислота, этиловый спирт, аммиак и другие), также являются ионизирующими растворителями: соли, кислоты и основания, растворенные в этих жидкостях, диссоциируют на ионы.
84. Степень диссоциации. Сила электролитов.
Если бы электролиты полностью диссоциировали на ионы, то осмотическое давление (и другие пропорциональные ему величина) всегда было бы в целое число раз больше значений, наблюдаемых в растворах неэлектролитов. Но еще Вант-Гофф установил, что коэффициент i выражается дробными числами, которые с разбавлением раствора возрастают, приближаясь к целым числам.
Читать дальшеИнтервал:
Закладка:








