Николай Глинка - Общая химия
- Название:Общая химия
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Николай Глинка - Общая химия краткое содержание
Учебное пособие предназначено для студентов нехимических специальностей высших учебных заведений. Оно может служить пособием для лиц, самостоятельно изучающих основы химии, и для учащихся химических техникумов и старших классов средней школы.
Легендарный учебник, переведенный на многие языки стран Европы, Азии, Африки и выпущенный общим тиражом свыше 5 миллионов экземпляров.
При изготовлении файла, использован сайт http://alnam.ru/book_chem.php
Общая химия - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
Аррениус объяснил этот факт тем, что лишь часть электролита диссоциирует в растворе на ионы, и ввел понятие степени диссоциации. Степенью диссоциации электролита называется отношение числа его молекул, распавшихся в данном растворе на ионы, к общему числу его молекул в растворе.
- 229 -
Позже было установлено, что электролиты можно разделить на две группы: сильные и слабые электролиты. Сильные электролиты в водных растворах диссоциированы практически нацело.
Понятие степени диссоциации к ним по существу неприменимо, а отклонение изотонического коэффициента i от целочисленных значений объясняется другими причинами (см. § 86). Слабые электролиты в водных растворах диссоциируют только частично, и в растворе устанавливается динамическое равновесие между недиссоциированными молекулами и ионами.
К сильным электролитам принадлежат почти все соли; из важнейших кислот и оснований к ним относятся HNO 3, H 2SO 4, HClO 4, HCl, HBr, HI, KOH, Ba(OH) 2и Ca()H) 2
К слабым электролитам относится большинство органических кислот, а из важнейших неорганических соединений к ним принадлежат H 2CO 3, H 2S, HCN, H 2SiO 3и NH 4OH..
Степень диссоциации принято обозначать греческой буквой α и выражать либо в долях единицы, либо в процентах. Так, для 0,1н. раствора CH 3COOH α = 0,013 (или 1,3%), а для 0.1 н. раствора HCN α = 10 -4(или 0.01%).
85. Константа диссоциации.
К равновесию, которое устанавливается в растворе слабого электролита между молекулами и ионами, можно применить законы химического равновесия и записать выражение константы равновесия. Например, для диссоциации уксусной кислоты
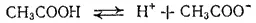
константа равновесия имеет вид
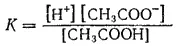
Здесь в числителе дроби стоят концентрации ионов —продуктов диссоциации, а в знаменателе — концентрация недиссоциированных молекул.
Константа равновесия, отвечающая диссоциации слабого электролита, называется константой диссоциации. Величина К зависит от природы электролита и растворителя, а также от температуры, но не зависит от концентрации раствора. Она характеризует способность данной кислоты или данного основания распадаться на ионы: чем выше К, тем легче электролит диссоциирует.
Многоосновные кислоты, а также основания двух- и более валентных металлов диссоциируют ступенчато. В растворах этих веществ устанавливаются сложные равновесия, в которых участвуют ионы различного заряда. Например, диссоциация угольной кислоты происходит в две ступени:
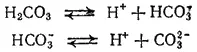
Первое равновесие — диссоциация по первой ступени — характеризуется константой диссоциации, обозначаемой K 1,
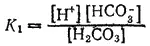
- 230 -
а второе — диссоциация по второй ступени — константой диссоциации K 2:
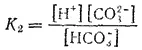
Суммарному равновесию
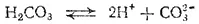
отвечает суммарная константа диссоциации К:
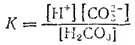
Величины K, K 1и K 2связаны друг с другом соотношением:
K=K 1K 2
Аналогичные соотношения характеризуют и ступенчатую диссоциацию оснований многовалентных металлов. Например, двум ступеням диссоциации гидроксида железа (II)
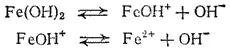
отвечают константы диссоциации:
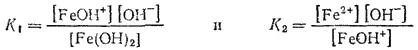
Суммарной диссоциации
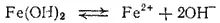
отвечает константа:
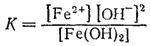
При этом
K=K 1K 2
При ступенчатой диссоциации веществ распад по последующей ступени всегда происходит в меньшей степени, чем по предыдущей (по второй меньше, чем по первой и т. д.). Иначе говоря, соблюдается неравенство:
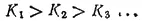
Это объясняется тем, что энергия, которую нужно затратить для отрыва иона, минимальна при его отрыве от нейтральной молекулы и становится больше при диссоциации по каждой следующей ступени.
Если обозначить концентрацию электролита, распадающегося на два иона, через С, а степень его диссоциации в данном растворе через α, то концентрация каждого из ионов будет Cα, а концентрация недиссоциированных молекул C(1-α). Тогда уравнение константы диссоциации принимает вид:
- 231 -
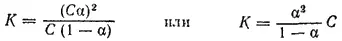
Это уравнение выражает закон разбавления Оствальда. Оно дает возможность вычислять степень диссоциации при различных концентрациях электролита, если известна его константа диссоциации. Пользуясь этим уравнением, можно также вычислить константу диссоциации электролита, зная его степень диссоциации при той или иной концентрации.
Для растворов, в которых диссоциация электролита очень мала, уравнение закона Оствальда упрощается. Поскольку в таких случаях α ≪ 1, то величиной α в знаменателе правой части уравнения можно пренебречь. При этом уравнение принимает вид:
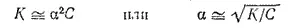
Это уравнение наглядно показывает связь, существующую между концентрацией слабого электролита и степенью его диссоциации: степень диссоциации возрастает при разбавлении раствора.
Полученный вывод вытекает из природы явления диссоциации. Как всякое химическое равновесие, равновесие в растворе слабого электролита является динамическим, т. е. при его установлении протекают с равными скоростями два процесса: процесс диссоциации и обратный ему процесс образования молекул из ионов. При этом разбавление раствора не препятствует первому из этих процессов — диссоциации. Однако процесс образования молекул из ионов в результате разбавления затрудняется: для образования молекулы должно произойти столкновение ионов, вероятность которого с разбавлением уменьшается.
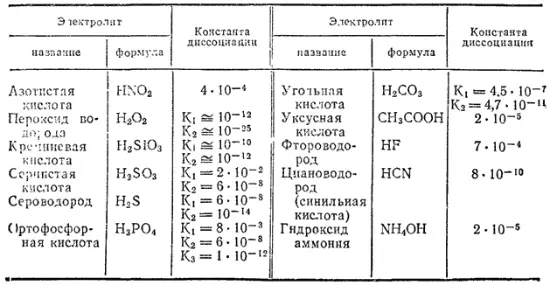
Таблица 12. Константы диссоциации некоторых слабых электролитов в водных растворах при 25°C
- 232 -
Читать дальшеИнтервал:
Закладка:








