Айзек Азимов - Популярная физика. От архимедова рычага до квантовой механики
- Название:Популярная физика. От архимедова рычага до квантовой механики
- Автор:
- Жанр:
- Издательство:Центрполиграф
- Год:2006
- Город:М.
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Айзек Азимов - Популярная физика. От архимедова рычага до квантовой механики краткое содержание
Популярная физика. От архимедова рычага до квантовой механики - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
А что произойдет, если, наоборот, добавить атому пару электронов? Ион хлора (Cl –) — это атом с хлора с «лишним» электроном. Если же добавить сульфату два, а фосфату — три электрона, то образуются сульфат (SO 4 ––) и фосфат (PO 4 –––) ионы.
Таким образом, по Трмсону, отрицательно заряженные электроны являются единственными субатомными частицами, но с их помощью можно объяснить существование и отрицательно, и положительно заряженных ионов.
Но у такой привлекательной на первый взгляд теории Томсона был один серьезный недостаток. Ленард обнаружил, что состоящие из электронов катодные лучи могут проникать сквозь различные предметы. Тогда если атом, как утверждал Томсон, является твердой сферой, то электронам, хотя они и крайне малы, все равно приходится буквально протискиваться между атомами других веществ. В этом случае после столкновения с преградой катодный луч должен рассеиваться, однако этого не происходит. Пройдя сквозь препятствие, пучок электронов остается таким же «кучным». Получается, что электроны проходят мимо атомов, не встречая особого сопротивления.
В 1903 году Ленард предположил, что атом на самом деле вовсе не твердое тело, а, по сути, пустота. По мнению ученого, атом состоял из электронов и равного им количества положительно заряженных частиц, благодаря которым заряд атома и оставался нейтральным.
Но почему тогда не существует анодных лучей?
Новозеландский физик Эрнест Резерфорд (1871–1937) примирил взгляды Ленарда и Томсона. Начиная с 1906 года он провел серию экспериментов, в ходе которых облучал тонкие золотые листы альфа-частицами [122] Альфа-частицы — это тяжелые, передвигающиеся с огромной скоростью частицы радиоактивных веществ, чья проникающая способность гораздо выше, чем у электронов.
. Под листами находилась фотопластинка.
Поток альфа-частиц с легкостью «пробивал» лист золота, словно того и вовсе не было, и засвечивал фотопластинку. Хотя толщина листа всего лишь 1/ 50000см, это все равно 20 000 атомов. Тот факт, что альфа-частицы с легкостью проходили сквозь 20 000 атомов, был доводом в пользу «пустого» атома Ленарда, то есть атома, состоящего лишь из нескольких легких частиц, разделенных пустотами.
Но самое интересное заключалось в том, что не все альфа-частицы проходили сквозь золотой лист беспрепятственно. Если альфа-луч не встречает на своем пути преград, то на фотопластинке остается четкий отпечаток. Однако если между источником альфа-излучения и фотопластинкой поместить лист золота, то контур отпечатка становится размытым. Проходя сквозь металл, альфа-частицы отклоняются от своей траектории на несколько градусов, а каждая восьмитысячная частица — на 90° и более!
Но почему? Почему практически все альфа-частицы легко проходят сквозь золото нетронутыми и лишь небольшая их часть так сильно меняет траекторию своего полета? Ведь масса альфа-частицы в 7350 раз больше массы электрона и в 4 раза больше массы атома водорода. Так что даже если альфа-частица столкнется с электроном, то она просто сметет его. Траектория изменится только в случае столкновения с объектом, масса которого приближается к массе атома. А поскольку лишь некоторые частицы встречают преграды на своем пути, размеры этого объекта должны быть крайне малы.
Это как мыльный пузырь, в центре которого находится свинцовый шарик. Если стрельнуть по такому пузырю дробью, то большинство дробинок пройдет сквозь него беспрепятственно, но некоторые попадут в шарик и отскочат от него. Зная частотность рикошетов, можно высчитать приблизительные размеры пузыря и шарика.
Но этот пример не совсем точно отображает суть происходящего. Альфа-частицы не сталкиваются с объектом внутри атома физически. Резерфорд доказал: взаимодействие между ними имеет электрическую природу. Дело в том, что альфа-частицы обладают положительным зарядом (+2), а объект в центре атома также несет положительный заряд, поэтому альфа-частица просто-напросто отталкивается от объекта.
В 1911 году Резерфорд представил миру свою модель атома. Атом состоит из электронов и атомного ядра, которое обладает огромной массой, однако размеры его гораздо меньше, чем предполагал Томсон.
Концепция ядерного атома Резерфорда ныне принята во всем мире.
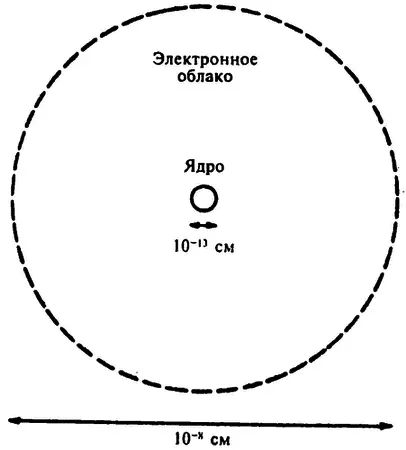
Судя по тому, как альфа-частицы отклоняются от своих траекторий, размеры ядра атома должны быть действительно крайне малы — от 10 –18до 10 –12см в диаметре, что составляет 1/ 100000, или 1/ 10000от диаметра самого атома. Объем атомного ядра составляет одну триллионную ( 1/ 1000000000000) часть объема атома.
По сути, практически вся масса атома сконцентрирована в его ядре. Даже ядро самого легкого атома — атома водорода — в 1836 раз тяжелее электрона, в то время как масса ядра атомов более тяжелых элементов может превосходить массу электрона почти в 500 000 раз. Естественно, тяжелое ядро намного менее подвижно, чем практически невесомый электрон, и именно поэтому под действием света и высокой температуры освобождаются только лишь электроны.
У Резерфорда, как и у Ленарда, атом также «пустой». Пространство за пределами ядра занимают электроны. Масса электронов крайне мала, и они не являются препятствием для катодных и альфа-лучей.
Происхождение ионов с точки зрения модели атома Резерфорда объясняется присоединением и потерей электронов, как и у Томсона.
Модель атома Резерфорда полностью удовлетворяла ученых, оставалось лишь доработать некоторые детали.
Особенности рентгеновского излучения
Теперь физики увидели атом как небольшое, но обладающее большой массой атомное ядро, окруженное электронами. Поскольку практически всю массу атома составляет ядро, то с увеличением атомного веса должна увеличиваться и масса ядра.
Логично предположить, что чем больше масса атомного ядра, тем выше его положительный заряд и тем больше электронов необходимо для того, чтобы заряд всего атома оставался нейтральным. А раз так, то постепенно становится ясным, в чем заключается различие между атомами различных химических элементов, и различие это вовсе не в массе, как считал Дальтон и остальные ученые XIX века. Различие имеет совершенно новую, электрическую природу. Атомы различных химических элементов отличаются зарядом ядра атома и количеством электронов за пределами ядра.
Эти два аспекта электрического различия атомов тесно связаны между собой, однако заряд — величина более постоянная, чем количество электронов. Под действием света и тепла электроны могут покинуть атом, превратив его в положительно заряженный ион, а появление в атоме дополнительных электронов приводит к образованию отрицательно заряженного иона. Несмотря на то что свойства иона разительно отличаются от свойств атома, от которого он образован, все-таки ион не является новым элементом. Другими словами, даже несмотря на то, что ион натрия по свойствам сильно отличается от атома натрия, даже физики и химики XIX века могли легко превратить его обратно в атом натрия, и хотя превратить ион калия в атом калия и наоборот они уже не могли, но в принципе это возможно. Значит, количество электронов не является ключевым отличием атома одного элемента от атома другого.
Читать дальшеИнтервал:
Закладка:









