Айзек Азимов - Популярная физика. От архимедова рычага до квантовой механики
- Название:Популярная физика. От архимедова рычага до квантовой механики
- Автор:
- Жанр:
- Издательство:Центрполиграф
- Год:2006
- Город:М.
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Айзек Азимов - Популярная физика. От архимедова рычага до квантовой механики краткое содержание
Популярная физика. От архимедова рычага до квантовой механики - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
Кроме того, благодаря открытию атомных чисел у периодической таблицы появляется еще одно свойство. Теперь с ее помощью можно не только предсказывать существование пока еще неизвестных элементов (что Менделеев и сделал), но и их несуществование.
Пока на вооружении ученых были лишь атомные веса, нельзя было сказать наверняка, что в будущем не будут открыты целые семейства новых элементов. Например, в 1890 году было открыто семейство инертных газов (гелий, неон, аргон, криптон и ксенон), и в таблицу тут же добавили новую колонку, ранее о существовании которой даже и не подозревали. Столетие спустя были открыты лантаноиды, и их тоже включили в таблицу. До Мозли никто не мог точно сказать, сколько еще оставалось неизвестных элементов. Десятки? Сотни? Тысячи?
Атомные числа не оставили места для подобных сомнений. Подразумевая, что атомное ядро не может нести дробный заряд, можно с уверенностью заявить, что между водородом (атомное число 1) и гелием (2) или, скажем, фосфором (15) и серой (16) никаких элементов нет.
Впервые химики могли сказать, сколько еще элементов предстояло открыть. Первым элементом в таблице является водород (атомное число 1), других элементов перед ним нет. Во времена Мозли самым тяжелым из известных элементов был уран (92). Между ними были лишь 7 неизвестных элементов с атомными числами 43, 91, 72, 75, 85, 87 и 91.
Рентгенографический анализ можно также использовать для проверки новых элементов. Например, в 1911 году французский химик Жорж Урбен (1872–1938) выделил, как ему показалось, новый элемент и дал ему название «кельтий». Когда Мозли опубликовал свой труд, Урбен решил, что кельтий — это как раз и есть неизвестный элемент с атомным числом 72, и привез образец на проверку к Мозли. Проанализировав уникальное рентгеновское излучение «нового» элемента, Мозли выяснил, что кельтий был на самом деле смесью двух уже известных элементов — иттербия и лютеция (атомные числа 70 и 71). Химические испытания это подтвердили, и потрясенный увиденным Урбен впоследствии сделал много для популяризации концепции атомных чисел.
В течение последующих 12 лет были заполнены 3 пустые клетки таблицы. В 1917 году был открыт протактиний (91), в 1923 году — гафний (72), в 1925 году — рений (75). Еще через 10 лет были заполнены оставшиеся четыре клетки (43, 61, 85, 87). Эти элементы мы рассмотрим ниже.
Зная заряд ядра атома элемента, можно судить и о количестве электронов в атоме. Конечно же атом может потерять или присоединить электроны и превратиться в положительно или отрицательно заряженный ион, но в атоме с нейтральным зарядом количество электронов должно соответствовать заряду ядра. Так, в атоме кислорода с зарядом ядра +18, для того чтобы заряд атома оставался нейтральным, должно присутствовать 18 электронов. То есть количество электронов в атоме равно атомному числу этого элемента. Таким образом, у атома водорода один электрон, у натрия — 11, а у урана — 92.
Электронные оболочки
Теперь возник еще один вопрос: как все эти электроны расположены в атоме? Томсон с его моделью атома в виде булочки с изюмом предположил, что электроны внутри атома расположены по кругам. Чем больше электронов — тем больше кругов.
И хотя модель атома Томсона и была вытеснена моделью атома с ядром Резерфорда, идея о том, что электроны находятся за пределами ядра, казалась вполне вероятной, а существование уникального рентгеновского излучения лишь подтверждало ее. Возможно, что каждая из групп лучей испускалась определенной группой электронов вокруг ядра. Электроны, находящиеся в непосредственной близости от ядра, удерживаются им сильнее, значит, они и производят самое жесткое излучение группы К. Электроны, находящиеся чуть дальше от ядра, будут производить излучения группы L и т. д. Приведенный ниже рисунок наглядно это иллюстрирует.
А почему, например, благородные газы (гелий, неон, аргон, криптон, ксенон и радон) практически не вступают в химические реакции? (На самом деле долгое время считалось, что они вообще ни с чем не реагируют, и только в 1962 году выяснилось, что с некоторыми элементами они все же реагируют.)
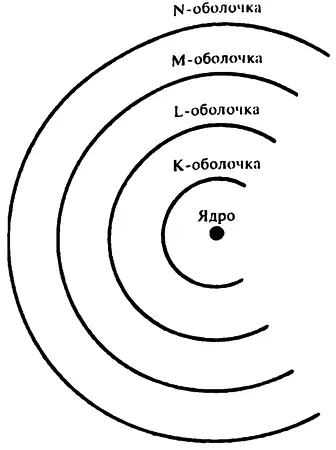
Одной из причин является то, что любая химическая реакция включает в себя в том числе и взаимодействие электронов внутри атомов. Например, хлорид натрия состоит из ионов натрия и газообразного хлора. В процессе реакции атом натрия теряет один электрон и становится положительно заряженным ионом Na +, а атом хлора присоединяет один электрон и становится отрицательно заряженным ионом Cl –.
Возможно, благородные газы не вступают в химические реакции потому, что уже обладают жесткой электронной структурой, а присоединение или потеря электронов приведет к потере этой структурной устойчивости.
Логично предположить, что эта устойчивость достигается полным заполнением одной из электронных оболочек.
Например, атомное число гелия равно 2, и гелий является благородным газом. Если атом гелия содержит два электрона, значит, ему необходимы лишь два электрона для полного заполнения внутренней электронной оболочки К. Атом следующего благородного газа — неона — в нейтральном состоянии обладает 10 электронами, 2 из которых заполняют оболочку К, а оставшиеся 8 — оболочку L. В каждом атоме аргона (атомное число 18) уже по 18 электронов, 2 из которых заполняют оболочку К, еще 8 — L, а оставшиеся 8 — оболочку М. В табл. 4 показано, как электроны по электронным оболочкам распределены у первых 20 элементов. (У элементов с большим атомным числом распределение становится уже более сложным, см. гл. 5.)
Вскоре после опубликования Мозли своих работ были сделаны первые попытки рассмотреть химические реакции с точки зрения распределения электронов по электронным оболочкам. Успехом увенчались попытки работавших независимо друг от друга американских химиков Гилберта Ньютона Льюиса (1875–1946) и Ирвинга Ленгмюра (1881–1957). Суть их теории вкратце заключается в том, что в процессе любой химической реакции элементы стараются потерять или присоединить электроны, чтобы перейти в такое же, как и у благородных газов, устойчивое состояние.
Так, натрий с распределением электронов по оболочкам 2/8/1 проявляет тенденцию отдать один электрон, чтобы превратиться в ион натрия (Na +) с распределением электронов 2/8, как у атома неона. Конечно же ион натрия не превращается в атом неона, так как заряд ядра (уникальный для каждого элемента) иона натрия остается +11, а заряд ядра атома неона равняется +10. То же можно сказать и о хлоре. Атом хлора с распределением электронов 2/8/7 проявляет тенденцию присоединить еще один электрон и стать ионом хлора (Cl –) с распределением электронов 2/8/8, как у атома аргона.
Читать дальшеИнтервал:
Закладка:









