Айзек Азимов - Популярная физика. От архимедова рычага до квантовой механики
- Название:Популярная физика. От архимедова рычага до квантовой механики
- Автор:
- Жанр:
- Издательство:Центрполиграф
- Год:2006
- Город:М.
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Айзек Азимов - Популярная физика. От архимедова рычага до квантовой механики краткое содержание
Популярная физика. От архимедова рычага до квантовой механики - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
Бор предположил, что электрон в основном состоянии обладает минимумом энергии и находится на ближайшей к ядру орбите. Такой электрон не выделяет энергию (истинная причина этого открылась лишь 10 лет спустя, см. гл. 6). После поглощения энергии электрон переходит в возбужденное состояние и в зависимости от количества этой энергии занимает одну из более удаленных от ядра орбит.
Бор определил несколько орбит электрона в атоме водорода в зависимости от величины кинетического момента. Используя постоянную Планка (см. ч. II), Бор вывел следующую формулу:
где p — кинетический момент электрона, h — постоянная Планка, π — это конечно же известная нам постоянная длины окружности; n — любое положительное целое. Теперь введем в формулу значение постоянной Планка, предположим, что электрон может двигаться только по определенным орбитам, примем за n любое целое число и получим квантованный атом.
В связанных с квантованным атомом вычислениях выражение h/2π используется часто, поэтому его обычно сокращают до ħ. Так как значение h приблизительно 6,6256∙10 –27эрг-с, значение π приблизительно 3,14159, то ħ приблизительно равно 1,0545∙10 –27эрг-с.
Таким образом, формула 5.9 приобретает вид:
Иногда n называют еще главным квантовым числом (кроме главного, существуют и другие квантовые числа). Это число обозначает орбиту, на которой находится электрон: n = 1 для ближайшей к ядру орбите; 2, 3, 4 и так далее — для более высоких.
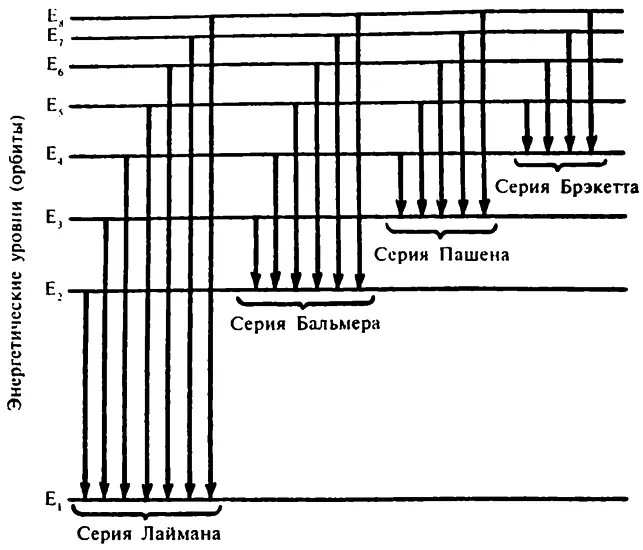
Когда единственный электрон атома водорода опускается с орбиты 2 на орбиту 1, он выделяет один квант (определенного размера) энергии, т. е. излучение определенной частоты, и в определенном месте спектра появится яркая линия. (А когда единственный электрон атома водорода поднимается с орбиты 1 на орбиту 2, он поглощает один квант (того же определенного размера), и на месте яркой спектральной линии появится еще и темная.)
Если единственный электрон атома водорода опустится с орбиты 3 на орбиту 1, то энергии при этом выделится больше, и частота излучаемого света будет выше. При перемещении с орбиты 3 (4, 5) на орбиту 1 частота будет еще выше.
Серия перемещений с различных орбит на орбиту 1 приведет к излучению света последовательно повышающейся частоты (или последовательно понижающейся длины волны), то есть серии волн Лаймана. Серия перемещений с более высоких орбит на орбиту 2 приведет к появлению серии Бальмера, на орбиту 3 — серии Пашена и т. д.
В описывающих длины волн спектральных линий различных серий формулах (5.5, 5.6, 5.7, 5.8) первое число знаменателя правой части и будет главным квантовым числом орбиты, куда опускается (или с которой поднимается) электрон.
Заряд ядра атомов более сложной, чем у водорода, структуры с несколькими электронами больше, следовательно, электроны на внутренней орбите удерживаются сильнее.
Поэтому для перемещения на более высокую орбиту электрону требуется больше энергии, а значит, и при переходе на более низкую орбиту энергии также освобождается больше. Самые короткие излучаемые водородом волны находятся в ультрафиолетовой части спектра (серия Лаймана), а более сложные атомы могут излучать и сверхкороткие рентгеновские лучи. Мозель обнаружил, что длина волн рентгеновского излучения уменьшается с возрастанием атомного числа элемента.
Дальше — хуже. Модель атома Бора вполне подходила для атомов водорода, чей спектр состоит из прямых линий. Однако более точный спектральный анализ показал, что спектральные линии водорода имеют тонкую структуру, состоящую из многих мелких линий, будто электрон при перемещении на другую орбиту «промахивается» и попадает на соседнюю.
Это едва не поставило крест на квантовой модели атома. Положение спас в 1916 году немецкий физик Арнольд Зоммерфельд (1868–1951), предложивший следующее объяснение: дело в том, что, по мнению Бора, электронные орбиты имели четкую форму круга, однако Зоммерфельд предположил, что она может быть и эллиптической. Квантовая модель атома допускала существование орбит с небольшим эксцентриситетом эллипса, а главное квантовое число — группы орбит, состоящих из одной круговой и нескольких эллиптических, так как изменения кинетического момента были незначительными.
Для эллиптических орбит Зоммерфельд ввел понятие орбитального квантового числа, получившего обозначение L [125] Вообще-то это число принято обозначать строчной латинской « l », но начертание строчной буквы схоже с начертанием цифры «1», поэтому во избежание путаницы, я и использую прописную «L».
. Орбитальное квантовое число может принимать любое значение в пределах от 0 до n – 1, то есть при n = 1 L = 0; при n = 2 L = 0 или 1; при n = 3 L = 0, 1 или 2 и т. д.
Но спектральные линии под действием магнитного поля расходятся еще больше. Ученые приняли это во внимание и ввели магнитное квантовое число (m).
С появлением магнитного атомного числа атом стали рассматривать уже в трех измерениях. Теперь варьировалась не только форма орбиты электрона, но и ее наклон относительно основной. Для т справедливы все значения L, кроме того, к положительным значениям добавились еще и отрицательные. То есть если для n = 2 L = 1 или 0, а m = 0, 1 и –1; для n = 3 L = 0, 1 или 2, а m = 0, 1, 2, –1 или –2 и т. д.
Последнее квантовое число — число спина электрона (s). Оно обозначает спин, т. е. направление вращения электрона вокруг своей оси, а поскольку таких направлений всего два — по часовой стрелке и против часовой, то и квантовое число может принимать лишь два значения: 1/2 и –1/2.
Электронные подоболочки
Электроны могут находиться лишь на описанных квантовыми числами орбитах. Когда электронов несколько (а у всех элементов, кроме водорода, их по два и более), они распределяются по орбитам, причем первой заполняется ближняя к ядру орбита.
Но сколько электронов могут находиться на одной и той же орбите одновременно? В 1925 году австрийский физик Вольфганг Паули (1900–1958) предположил, что, раз спектр каждого элемента уникален, значит, внутри каждого атома не могут существовать электроны с идентичными квантовыми числами, хотя бы одно из четырех должно отличаться. То есть на произвольной орбите, будь то круговая, эллиптическая или накрененная, могут вращаться максимум 2 электрона, причем один из них по часовой стрелке, а второй — против. Этот принцип существования двух электронов с противоположными спинами называется принцип исключения Паули.
Читать дальшеИнтервал:
Закладка:









