Айзек Азимов - Популярная физика. От архимедова рычага до квантовой механики
- Название:Популярная физика. От архимедова рычага до квантовой механики
- Автор:
- Жанр:
- Издательство:Центрполиграф
- Год:2006
- Город:М.
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Айзек Азимов - Популярная физика. От архимедова рычага до квантовой механики краткое содержание
Популярная физика. От архимедова рычага до квантовой механики - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
Для достижения стабильности с понижением атомного веса должно понижаться и соотношение n/p. Для этого нейтрон превращается в прогон, и происходит излучение бета-частицы. Путем комбинации альфа- и бета-излучений уран–238 становится свинцом–206, теряя при этом 10 протонов и 22 нейтрона, то есть соотношение n/p уменьшается с 1,59 до 1,51.
Совпадения в комбинациях протонов и нейтронов говорят о том, что структура ядер стабильных элементов формируется согласно каким-то определенным закономерностям, а не хаотично. По аналогии с периодической таблицей, основанной, как выяснилось позже, на существовании электронных оболочек, некоторые физики пытались объяснить свойства ядер на основе системы ядерных оболочек.
В 1948 году польский физик Мария Гёпперт-Майер (1906–1972) развила эту систему. Она обнаружила, что наиболее стабильные или наиболее часто встречающиеся изотопы, ядра которых содержат определенное количество нейтронов и протонов. Это количество называется оболочечным числом или более ярким термином «магическое число». Нейтроны и протоны имеют числа, равные 2, 8, 20, 50, 82 и 126.
Например, ядро гелия–4 состоит из 2 протонов и 2 нейтронов, кислорода–16 — из 8 протонов и 8 нейтронов, кальция–40 — из 20 протонов и 20 нейтронов. Все эти три изотопа очень стабильны. Элементом с самым большим количеством стабильных изотопов является олово, ядро которого содержит 50 протонов. Также существуют 6 встречающихся в природе изотопов, ядра которых имеют 50 нейтронов (сюда относится и слаборадиоактивный рубидий–87). Есть еще 7 стабильных изотопов, ядра которых содержат 82 нейтрона, и 4 изотопа (свинца), ядра которых имеют по 82 протона.
И дело здесь даже не в количестве изотопов. Те или иные ядерные свойства достигают своего максимума (или минимума) у элементов, ядра которых содержат магическое число нейтронов и протонов. Так, изотопы, ядра которых содержат магическое число протонов или нейтронов, имеют меньшее ядерное сечение, чем другие, схожие по сложности, элементы.
Гёпперт-Майер объясняла феномен магических чисел существованием состоящих из протонов и нейтронов нуклонных оболочек, заполняющихся согласно ядерным квантовым числам. Магические числа означают полностью заполненные оболочки (как в случае с электронными оболочками благородных газов).
У «ядерной периодической таблицы» есть целый ряд побед. С ее помощью удалось определить, какие нуклиды могут существовать в возбужденном состоянии длительное время, образуя ядерные изомеры (см. гл. 8). И все же эта модель довольно противоречива.
Коэффициент уменьшения массы
Стабильность определенного нуклида зависит не только от соотношения п/р, но и, что более важно, от энергии этого нуклида по отношению к другим нуклидам с таким же количеством нуклонов.
Чтобы лучше понять это, начнем с осознания того, что, хотя массовое число изотопа обычно приводится числом целым, на самом деле оно «не совсем» целое. Говоря о кислороде–18, калии–41 и уране–235, мы подразумеваем, что их массовые числа равны соответственно 18, 41 и 235.
С помощью масс-спектрографа Астона (см. гл. 8) удалось с огромной точностью измерить массы отдельных изотопов. Мы знаем, что по отношению к углероду–12 фактическая масса кислорода–18 равна 17,99916, калия–41 — 40,96184, а урана–235 — 23,0439.
Если считать, что ядро состоит из одних лишь нейтронов и протонов, то получились весьма странные результаты. Но разве масса одного нейтрона или протона равна 1? Нет. Относительно углерода–12 масса протона составляет 1,007825, а нейтрона — 1,00865.
Но тогда возникает другой вопрос. Ядро углерода–12 состоит из 6 протонов и 6 нейтронов. Но общая масса 12 отдельно взятых нуклонов равна 12,098940, однако масса тех же самых 12 нуклонов ядра углерода–12 составляет 12,00000, то есть дефект массы равен 0,098940. Куда же делась эта масса?
Понятно, что, согласно формуле Эйнштейна (см. ч. II), избыточная масса перешла в энергию.
При образовании ядра углерода–12 менее 1% общей массы 6 протонов и 6 нейтронов переходит в энергию. Для разложения ядра углерода–12 на отдельные нуклоны требуется энергия, которую накопить достаточно сложно, и именно поэтому ядро углерода–12 не распадается. Энергия, удерживающая нуклоны внутри ядра, гораздо выше энергии, удерживающей атомы внутри молекулы и молекулы внутри твердого вещества. Она также выше энергии, удерживающей электроны внутри атома. Именно поэтому расплавка твердого вещества, разложение химического соединения или даже ионизация атома — плевое дело по сравнению с расщеплением ядра.
И хотя без применения колоссальной энергии расщепить атомное ядро невозможно, внутри его можно провести менее кардинальные изменения, и некоторые из этих изменений происходят спонтанно.
Начнем с того, что чем больше энергии на одну частицу отдается во время формирования ядра путем «упаковки» нескольких отдельных электронов вместе, тем более стабильным будет ядро (при прочих равных). Измерить эту энергию образования ядра можно, выделив массовое число (A) из фактической массы изотопа (A m). Полученное значение дефекта массы можно разделить на фактическую массу и получить дробное значение дефекта массы. Чтобы избавиться от дроби, результат умножается на 10 000, и в итоге получаем то, что Астон назвал коэффициентом уменьшения массы. Если обозначить его как P t, то
Чем меньше коэффициент уменьшения массы, тем больше потери массы при образовании ядра и тем выше его стабильность.
Самый высокий коэффициент уменьшения массы у водорода. Фактическая масса ядра водорода–1 (голого протона) равна 1,007825. Подставив это значение (1,007825) в формулу 11.1 вместо A m, а 1 — вместо A, коэффициент уменьшения массы получим 78,25, что неудивительно, так как единственный протон при формировании ядра никуда не «упаковывается». У отдельного нейтрона коэффициент уменьшения массы еще больше — 86,7.
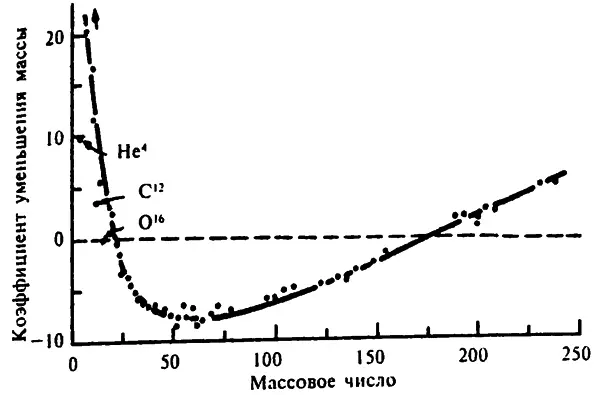
С другой стороны, коэффициент уменьшения массы лития–7 равен 22.9. при A m = 7,01601, а A = 7, в то время как коэффициент уменьшения массы углерода–13 равен 2,4, при A m— 13,00335,
В целом коэффициент уменьшения массы нескольких следующих за водородом–1 элементов уменьшается. Это говорите том что с усложнением ядра отношение n/p становится более «стабильным». Проще говоря, когда два простых ядра образуют более сложное, выделяется энергия.
Коэффициент уменьшения массы азота–15 равен уже 0, однако у ядер еще более сложных элементов этот коэффициент принимает отрицательные значения. (Как следствие того, что мы приняли атомное число углерода–12 за 12. Если бы мы высчитывали атомные веса относительно того, что атомный вес железа–56 равен 56, то коэффициент уменьшения массы не имел бы отрицательных значений.)
Читать дальшеИнтервал:
Закладка:









