Айзек Азимов - Популярная физика. От архимедова рычага до квантовой механики
- Название:Популярная физика. От архимедова рычага до квантовой механики
- Автор:
- Жанр:
- Издательство:Центрполиграф
- Год:2006
- Город:М.
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Айзек Азимов - Популярная физика. От архимедова рычага до квантовой механики краткое содержание
Популярная физика. От архимедова рычага до квантовой механики - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
или
Нептуний–238 испускал бета-частицу и становился изотопом элемента 94 с достаточно высокой для обнаружения радиоактивностью. Новый элемент получил название плутоний, в честь планеты Плутон, находящейся еще дальше, чем Нептун.
Как только плутоний удалось получить в достаточном количестве, его подвергли бомбардировке альфа-частицами, в 1944 году исследовательская группа во главе с Сиборгом получила изотопы элемента 95 (америций, в честь Америки) и 96 (кюрий, в честь Кюри).
Группе Сиборга удалось получить элементы и с большим атомным числом. В 1949-м и 1950 годах путем бомбардировки америция и кюри альфа-частицами были получены элементы 97 и 98.
Элемент 97 получил название берклий, а элемент 98 — калифорний, в честь города Беркли в штате Калифорния, где находилась исследовательская лаборатория.
В лабораторных условиях элементы 99 и 100 удалось получить в 1954 году, однако двумя годами ранее, в 1952 году, изотопы этих элементов были обнаружены в осадках после взрыва водородной бомбы во время испытаний на острове в Тихом океане. Ко времени подтверждения и опубликования результатов открытий Эйнштейн и Ферми уже умерли, и в их честь элементы 99 и 100 были названы эйнштейний и фермий.
В 1955 году в результате бомбардировки эйнштейния альфа-частицами был получен элемент 101, менделевий, названный так в часть создателя периодической таблицы Менделеева. В 1957 году институт Нобеля в Стокгольме объявил об открытии элемента 102, нобелия [137] Попытки повторить опыт шведов провалились. Элемент 102 удалось получить методами, отличными от использованных в институте Нобеля, и название «нобелий» до сих пор официально не принято.
, а в 1961 году был обнаружен элемент 103, названный лавренцием (лоуренсием) в честь изобретателя циклотрона, умершего за несколько лет до этого. В 1964 году советские физики объявили о получении элемента 104, но эта информация подтвердилась не сразу.
| Атомное число | Химический элемент | Массовое число наиболее долгоживущего изотопа | Период полураспада |
| 93 | Нептуний | [237] | 2 140 000 лет |
| 94 | Плутоний | [242] | 37 900 лет |
| 95 | Америций | [243] | 7650 лет |
| 96 | Кюрий | [247] | Ок. 40 000 000 лет |
| 97 | Берклий | [247] | Ок. 10 000 лет |
| 98 | Калифорний | [251] | Ок. 800 лет |
| 99 | Эйнштейний | [254] | 480 дней |
| 100 | Фермий | [253] | Ок. 4,5 дня |
| 101 | Менделевий | [256] | 1,5 часа |
| 102 | Нобелий | [253] | Ок. 10 минут |
| 103 | Лоуренсий | [257] | 8 секунд |
Элементы выше урана называются трансурановыми. Удалось получить более сотни изотопов этих элементов. В табл. 11 представлены наиболее долгоживущие из известных изотопов этих элементов.
Основной теоретический интерес к этим элементам заключается в том, что они Пролили свет на верхнюю часть периодической таблицы. До открытия трансурановых элементов, на основе некоторых опытных химических данных, торий в периодической таблице поместили под гафнием, протактиний — под танталом, а уран — под вольфрамом.
Согласно этому принципу, открытый нептуний следовало бы поместить перед рением. Однако химические свойства нептуния были аналогичны свойствам урана и трансурановых элементов. Оказалось (Сиборг первым предположил это), что элементы начиная с актиния образовывали новый ряд «редкоземельных» элементов (см. гл. 1), соответственно их нужно поместить под первым рядом редкоземельных элементов (от лантана и далее), что и сделано в периодической таблице (см. гл. 1).
Первый ряд, от лантана до лютеция включительно, сегодня называют лантаноидами, по названию первого члена этого ряда. По аналогии второй ряд, от актиния до лавренция включительно, называют актинидами. Лавренций является последним членом ряда актинидов, и химики уверены, что, как только элемент 104 удастся получить в достаточном для изучения его химических свойств количестве, окажется, что он по своим свойствам будет похож на гафний.
Хотя периоды полураспада некоторых изотопов трансурановых элементов и длинные по человеческим меркам, по меркам геологическим все они слишком короткие. (Тем не менее следы нептуния и плутония были найдены в урановых рудах. Они появились в результате взаимодействия нейтронов и урана, вызванного ядерной реакцией, возникающей под действием космических излучений высокой энергии.)
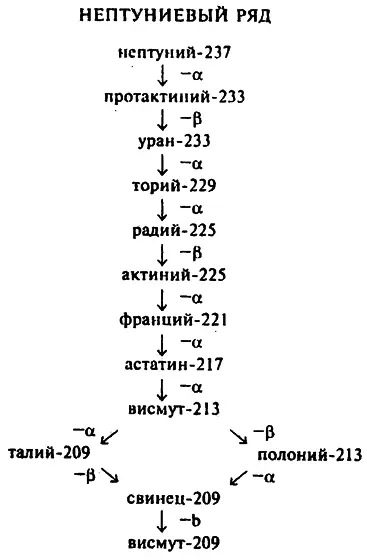
Особенный интерес представляет нептуний–237. В результате деления его массового числа на 4 остаток равен 1, значит, нептуний–237 принадлежит к ряду элементов 4x + 1. Элементы этого радиоактивного ряда в природе не встречаются (см. гл. 8). Период полураспада нептуния–237 более 2 миллионов лет, и, по последним сведениям, это самый долгоживущий элемент данного ряда. Значит, нептуний–237 вполне может быть родительским элементом нептуниевого ряда. Его дочерние элементы не повторяют ни один из элементов трех других радиоактивных рядов (см. табл. 12).
Основной чертой нептуниевого ряда является то, что он, в отличие от трех других рядов, заканчивается висмутом, а не свинцом. Раз родительский элемент не дошел до наших дней, то не дошли и менее долгоживущие дочерние элементы. Из всего ряда встречается только конечный стабильный изотоп — висмут–209.
Глава 11.
СТРУКТУРА ЯДРА
Нуклоны, четность и нечетность
Когда перед глазами весь список изотопов — стабильных и нестабильных, — можно сделать определенные утверждения о структуре ядра.
Для начала возьмем атом, ядро которого состоит из одного лишь протона. Получим атом водорода–1. Ядро не может содержать больше одного электрона, если в нем нет нейтронов. Среди элементов с маленькими атомами стабильные ядра состоят из равного или почти равного количества протонов и нейтронов. Так, у ядра водорода–2 1 протон и 1 нейтрон, у гения-4 — 2 протона и 2 нейтрона, у углерода–12 — 6 протонов и 6 нейтронов, у кислорода–16 — 8 протонов и 8 нейтронов, у серы–32 — 16 протонов и 16 нейтронов, у кальция–40 — 20 протонов и 20 нейтронов.
Дальше ситуация меняется. Стабильные ядра всех элементов тяжелее кальция–40 содержат больше нейтронов, чем протонов, причем чем выше массовое число, тем больше дисбаланс между нейтронами и протонами. Так, ядро наиболее распространенного изотопа железа — железо–56 — состоит из 26 протонов и 30 нейтронов, то есть соотношение нейтронов и протонов (n/p) равно 1,15. Ядро наиболее распространенного изотопа серебра — серебро–107 — состоит из 47 протонов и 60 нейтронов, соотношение n/p равно 1,27. Ядро единственного стабильного изотопа висмута — висмута–209 — состоит из 83 протонов и 126 нейтронов, соотношение n/p равно 1,52. Ядро наиболее тяжелого из встречающихся в природе изотопов урана — урана–238 — состоит из 92 протонов и 146 нейтронов, то есть соотношение n/p равно 1,59.
Читать дальшеИнтервал:
Закладка:









