Леонид Пономарев - По ту сторону кванта
- Название:По ту сторону кванта
- Автор:
- Жанр:
- Издательство:Молодая гвардия
- Год:1971
- Город:Москва
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Леонид Пономарев - По ту сторону кванта краткое содержание
Эта книга не для знатоков, хотя и они найдут здесь несколько неожиданных фактов. Она для тех, кто заканчивает школу, и для тех, кто пытается посмотреть на мир немного шире, чем позволяет им их специальность — необходимо узкая, чтобы быть продуктивной.
В предлагаемой книге история атома рассказана вполне строго. Но строгость в ней не самоцель: как правило, нам интересны не только сами факты, но и их толкование и обстоятельства, при которых они открыты. Поэтому главное в книге — эволюция идей и понятий атомной физики, образующих единую систему — простую и гармоничную. Именно эта внутренняя красота была побудительной причиной появления книги. Я буду считать свою работу не напрасной, если прочитавший ее почувствует силу логических построений квантовой механики и красоту их неожиданно простых следствий.
По ту сторону кванта - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
явление — > образ — > понятие — > формула — > опыт,
которая лежит в основе всего физического знания. Последнее звено в этой цепи — опыт проверяет, насколько правильно мы представляем себе явление в целом на основе частичных знаний о нем.
Но эта простая схема не поможет нам ответить на вопрос «Что такое атом?» просто потому, что явление «атом» не воздействует на наши органы чувств, и они не могут дать нам никакого, даже приблизительного, «образа атома». Поэтому вначале понятие «атом» возникло чисто умозрительно, без ссылок на органы чувств и в течение двадцати веков оставалось не более чем любопытной гипотезой, которая ничем не лучше других гипотез о строении материи.
Настоящая история атома началась с приходом науки, когда люди стали полагаться не только на свои органы чувств, но научились также доверять показаниям приборов. С помощью приборов они наблюдали, как ведут себя тела при растворении, при пропускании через раствор электрического тока, при нагревании, при освещении и при многих других воздействиях. Ученые не просто наблюдали эти явления, но изучали их, то есть измеряли температуру тел, длину волны излучаемого ими света и многое другое, о чем мы уже знаем. Результаты своих измерений они записывали в виде чисел , Вот эти-то числа и заменили физикам те непосредственные ощущения, которые доставляли им ранее органы чувств. Числа — вот единственное, чему они стали доверять, когда стали изучать явления, недоступные непосредственному восприятию. Имея в руках числа, они стали находить между ними связи и записывать эти связи в виде формул .
Но люди общаются не с помощью формул, а с помощью слов, и, чтобы рассказать о новых связях в природе, они придумывают понятия, которые соответствуют формулам. Иногда эти понятия очень необычны, но люди к ним быстро привыкают, учатся правильно пользоваться ими и даже создают для себя какие-то образы, которые они связывают с новыми понятиями.
Цепочка познания переворачивается:

В истории атома эту цепочку можно легко проследить: Фраунгофер, Кирхгоф и Бунзен обнаружили, что каждый атом испускает строго определенный набор спектральных линий (явление) и каждой спектральной линии соответствует число — длина волны λ, (опыт). Бальмер, Ридберг и Ритц нашли между этими числами простые связи (формула), а Бор показал, что их формулы следуют из единого принципа, который назвали квантованием (понятие). Наконец на основе этих опытов, формул и понятий возник образ — атом Бора.
Но опыты продолжались, они приносили новые числа и факты, которые уже не вмещались в рамки прежних формул, понятий и образов. И тогда возникла квантовая механика — единый принцип, из которого следовали все прежние эмпирические формулы и удачные догадки.
До сих пор мы довольно много узнали об опытах атомной физики и о понятиях, которые необходимо использовать, чтобы эти опыты объяснить. Но мы хотим большего: на этом новом, более высоком уровне знаний мы хотим создать > образ атома . Для этого нам нужно, хотя бы бегло, коснуться формул квантовой механики. Это необходимо — в конце концов красота логических построений в науке много важнее, чем эффекты неожиданных ассоциаций.
УРАВНЕНИЕ ШРЕДИНГЕРА
Предыдущие рассказы о квантовой механике почти убедили нас в том, что электрон в атоме не имеет определенного положения или хотя бы какой-нибудь орбиты, по которой он движется. Взамен этого мы пока что усвоили довольно туманную идею о том, что при движении в атоме электрон «расплывается».
Эту неопределенную идею Шредингеру удалось выразить весьма точно на однозначном языке формул. Уравнение Шредингера, как и всякий глубокий закон природы, нельзя вывести строго из более простых. Его можно только угадать. Шредингер так и сделал, и впоследствии признавался, что сам не вполне понимает, как это ему удалось. Но после того как уравнение угадано, надо еще научиться им пользоваться: надо знать, что означают все символы в уравнении и какие явления в атоме они отображают.
Уравнение Шредингера
[(d 2ψ)/(dx 2) + 2m/ħ 2][E — U (x)(x)]ψ = 0
мы уже приводили однажды и объясняли смысл входящих в него символов: ħ — постоянная Планка h, деленная на 2π m — масса электрона, Е — полная энергия электрона в атоме a U(х) — его потенциальная энергия, которая показывает, с какой силой притягивался бы электрон к ядру, если бы он был частицей и находился от него на расстоянии х. Но нам по-прежнему неясен смысл волновой функции пси (ψ). Чтобы ронять его, обратимся снова к аналогии с колеблющейся струной.
Ее уравнение
[(d 2U)/(dx 2)] + [2π/λ] 2U = 0
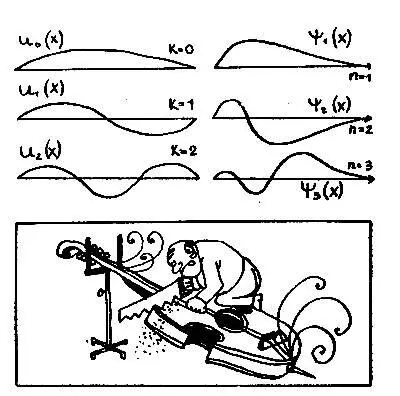
очень похоже на уравнение Шредингера. Несколько решений уравнения струны, функции U = U k(x), изображено на рисунке. Это обычные, знакомые всем синусоиды, и смысл их очевиден: они изображают форму струны в какой-то момент времени, то есть моментальную фотографию процесса ее колебания. Форма колебаний струны зависит от числа узлов k — точек, остающихся неподвижными в процессе колебания. Поэтому существует бесконечно много решений U=U k(x), которые различаются между собой числом узлов k.
Теперь взгляните на рисунок, где рядом с синусоидами струны U k((x) изображены решения ψ = ψ n(x) уравнения Шредингера для атома водорода. Они очень похожи. И если даже никаких реальных колебаний, подобных движениям струны, в атоме не происходит, то аналогия не становится от этого менее полезной.
Отмеченная аналогия позволяет пронумеровать решения ψ n(x) целым числом n точно так же, как решения U k(x) нумеруются целым числом к. Более того, оказалось, что целое число n — это и есть то самое непонятное квантовое число , которым Бор нумеровал орбиты электрона в атоме. Теперь оно потеряло свой мистический оттеннок: n — не что иное, как число узлов волновой функции, увеличенное на единицу (n = k + l).
Первый постулат Бора неким «усилием воли» предписывал электронам двигаться только по тем орбитам в атоме, которые удовлетворяют квантовому условию:
m v; к = n(h/2π)
Это был плодотворный, но неестественный для физики принцип, и потому он вызвал у современников сложную смесь восхищения и недовольства. Требование Шредингера значительно естественнее: как бы хитро ни двигался электрон в атоме, он должен все-таки находиться внутри атома. Поэтому ψ-функция, которая это движение «представляет», независимо от своей природы должна быть сосредоточена вблизи ядра. Это единственное граничное условие позволило вывести из уравнения Шредингера все: условия квантования Бора, энергию электрона на стационарных орбитах, смысл квантовых чисел.
Читать дальшеИнтервал:
Закладка:









