А. Березовчук - Физическая химия: конспект лекций
- Название:Физическая химия: конспект лекций
- Автор:
- Жанр:
- Издательство:Конспекты, шпаргалки, учебники «ЭКСМО»b4455b31-6e46-102c-b0cc-edc40df1930e
- Год:2009
- Город:Москва
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
А. Березовчук - Физическая химия: конспект лекций краткое содержание
Данное учебное пособие предназначено для студентов химических факультетов высших учебных заведений педагогического и технического направления. Изложены основные концепции и процессы, составляющие современную физическую химию. Материал соответствует государственному стандарту. Пособие рекомендовано в помощь студентам при подготовке к экзаменам.
Физическая химия: конспект лекций - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
Она показывает изменение количества вещества по числу молей. Если реакция не началась, то ξ γ= 0. Если количество исходных веществ превратилось в такое же количество продуктов реакции, то ξ γ= 1.
3H 2+ N 2= 2NH 3; ξ γ= 1,
1,5H 2+ 0,5N 2= NH 3; ξ γ= 0,5,
v 1 А 1+ v 2 А 2= v 3 А 3+ v 4 А 4 , – газовая реакция.
Рассчитать равновесный состав по третьему компоненту при условии, что А = а моль/л; В = в моль/л.
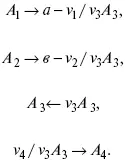
Рассчитываем по 4 компоненту:
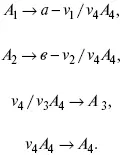
Задача.
Газообразные вещества реагируют по уравнению:
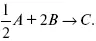
Общее давление в газовой смеси – Р общ, общий объем – V об . Рассчитать K P и K с.
Найти парциальное давление каждого компонента.
Вещества А и В превращаются в С в количестве Х. Исходные вещества А= 2 моль, В= 1 моль.
Для того, чтобы найти парциальное давление, мы должны Р обумножить на мольную долю. Мольная доля определяется отношением числа молей каждого компонента, отнесенного к общему числу молей всех компонентов.
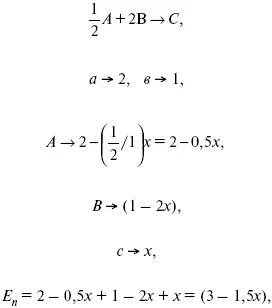
где E n – общее число молей, участвующих в этой газовой смеси.
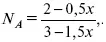
где N A– мольная доля А.
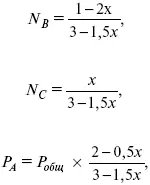
где Р А– парциальное давление.
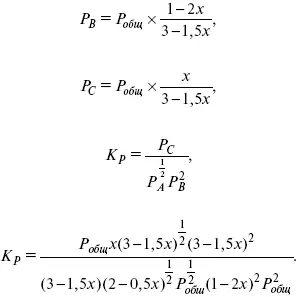
Расчет K c:
Δ v = l – 0,5 – 2 = – 1,5,
где Δ v – изменение количества молей.
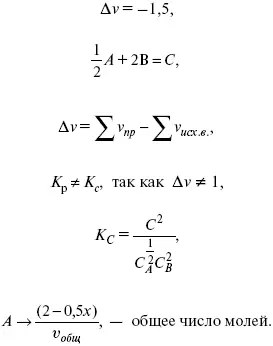
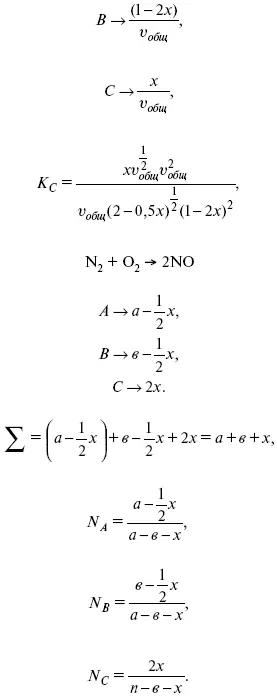
ЛЕКЦИЯ № 6. Химическая кинетика
1. Понятие химической кинетики
Кинетика– наука о скоростях химических реакций.
Скорость химической реакции– число элементарных актов химического взаимодействия, протекающих в единицу времени в единицу объема (гомогенные) или на единице поверхности (гетерогенные).
Истинная скорость реакции:
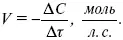
2. Факторы, влияющие на скорость химической реакции
Для гомогенных, гетерогенных реакций:
1) концентрация реагирующих веществ;
2) температура;
3) катализатор;
4) ингибитор.
Только для гетерогенных:
1) скорость подвода реагирующих веществ к поверхности раздела фаз;
2) площадь поверхности.
Главный фактор – природа реагирующих веществ – характер связи между атомами в молекулах реагентов.
Пример:
NO 2– оксид азота (IV) – лисий хвост, СО – угарный газ, монооксид углерода.
Если их окислить кислородом, то в первом случае реакция пойдет мгновенно, стоит приоткрыть пробку сосуда, во втором случае реакция растянута во времени.
Концентрация реагирующих веществ будет рассмотрена ниже.
Пример:
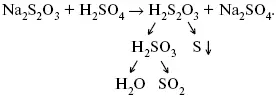
Голубая опалесценция свидетельствует о моменте выпадения серы, чем выше концентрация, тем скорость выше.
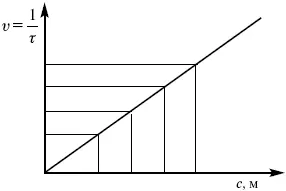
Рис. 10
Чем больше концентрации Na 2S 2O 3, тем меньше времени идет реакция. На графике (рис. 10) изображена прямо пропорциональная зависимость. Количественная зависимость скорости реакции от концент-рации реагирующих веществ выражается ЗДМ (законом действующих масс), который гласит: скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ.
Итак, основным законом кинетикиявляется установленный опытным путем закон: скорость реакции пропорциональна концентрации реагирующих веществ, пример: (т.е. для реакции)
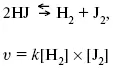
Для этой реакции Н 2+ J 2= 2НJ – скорость можно выразить через изменение концентрации любого из веществ. Если реакция протекает слева направо, то концентрация Н 2и J 2будет уменьшаться, концентрация НJ – увеличиваться по ходу реакции. Для мгновенной скорости реакций можно записать выражение:
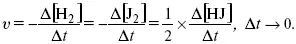
квадратными скобками обозначается концентрация.
Физический смысл k– молекулы находятся в непрерывном движении, сталкиваются, разлетаются, ударяются о стенки сосуда. Для того, чтобы произошла химическая реакция образования НJ, молекулам Н 2и J 2надо столкнуться. Число же таких столкновений будет тем больше, чем больше молекул H 2и J 2содержится в объеме, т. е. тем больше будут величины [Н 2] и [J 2]. Но молекулы движутся с разными скоростями, и суммарная кинетическая энергия двух сталкивающихся молекул будет различной. Если столкнутся самые быстрые молекулы Н 2и J 2, энергия их может быть такой большой, что молекулы разобьются на атомы йода и водорода, разлетающиеся и взаимодействующие затем с другими молекулами Н 2+ J 2 →2H+2J, далее будет H + J 2 →HJ + J. Если энергия сталкивающихся молекул меньше, но достаточно велика для ослабления связей H – H и J – J, произойдет реакция образования йодоводорода:
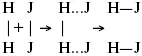
У большинства же сталкивающихся молекул энергия меньше необходимой для ослабления связей в Н 2и J 2. Такие молекулы «тихо» столкнутся и также «тихо» разойдутся, оставшись тем, чем они были, Н 2и J 2. Таким образом, не все, а лишь часть столкновений приводит к химической реакции. Коэффициент пропорциональности (k) показывает число результативных, приводящих к реакции соударений при концентрациях [Н 2] = [J 2] = 1моль. Величина k– const скорости. Как же скорость может быть постоянной? Да, скоростью равномерного прямолинейного движения называют постоянную векторную величину, равную отношению перемещения тела за любой промежуток времени к значению этого промежутка. Но молекулы движутся хаотически, тогда как же может быть скорость – const? Но постоянная скорость может быть только при постоянной температуре. С ростом температуры увеличивается доля быстрых молекул, столкновения которых приводят к реакции, т. е. увеличивается константа скорости. Но увеличение константы скорости не безгранично. При какой-то температуре энергия молекул станет столь большой, что практически все соударения реагентов будут результативными. При столкновении двух быстрых молекул будет происходить обратная реакция.
Читать дальшеИнтервал:
Закладка:










