Майкл Файер - Абсолютный минимум. Как квантовая теория объясняет наш мир
- Название:Абсолютный минимум. Как квантовая теория объясняет наш мир
- Автор:
- Жанр:
- Издательство:Питер
- Год:2015
- Город:Санкт-Петербург
- ISBN:978-5-496-01069-6
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Майкл Файер - Абсолютный минимум. Как квантовая теория объясняет наш мир краткое содержание
Физика — это сложнейшая, комплексная наука, она насколько сложна, настолько и увлекательна. Если отбросить математическую составляющую, физика сразу становится доступной любому человеку, обладающему любопытством и воображением. Мы легко поймём концепцию теории гравитации, обойдясь без сложных математических уравнений. Поэтому всем, кто задумывается о том, что делает ягоды черники синими, а клубники — красными; кто сомневается, что звук распространяется в виде волн; кто интересуется, почему поведение света так отличается от любого другого явления во Вселенной, нужно понять, что всё дело — в квантовой физике. Эта книга представляет (и демистифицирует) для обычных людей волшебный мир квантовой науки, как ни одна другая книга. Она рассказывает о базовых научных понятиях, от световых частиц до состояний материи и причинах негативного влияния парниковых газов, раскрывая каждую тему без использования специфической научной терминологии — примерами из обычной повседневной жизни. Безусловно, книга по квантовой физике не может обойтись без минимального набора формул и уравнений, но это необходимый минимум, понятный большинству читателей. По мнению автора, книга, популяризирующая науку, должна быть доступной, но не опускаться до уровня читателя, а поднимать и развивать его интеллект и общий культурный уровень. Написанная в лучших традициях Стивена Хокинга и Льюиса Томаса, книга популяризирует увлекательные открытия из области квантовой физики и химии, сочетая представления и суждения современных учёных с яркими и наглядными примерами из повседневной жизни.
Абсолютный минимум. Как квантовая теория объясняет наш мир - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
На рис. 14.12 показано, что бутан имеет другой изомер, называемый изобутаном. В изобутане центральный атом углерода соединён с тремя другими атомами углерода и одним атомом водорода, а остальные атомы углерода соединены только с центральным атомом углерода и тремя атомами водорода каждый. Все четыре атома углерода используют для образования связей sp 3-гибридизированные атомные орбитали и имеют тетраэдрическую конфигурацию. Об изобутане также говорят как о разветвлённой цепи. Тот факт, что бутан может при одинаковом числе атомов углерода и водорода иметь две разные структуры, очень важен. У молекулы с бо́льшим числом атомов углерода число возможных вариантов строения может быть намного больше двух.
В дополнение к двум структурным изомерам н-бутан имеет два конформера. Конформеры — это различные формы, конформации, одного и того же набора атомов, соединённых одним и тем же способом. Они различаются за счёт того, что вокруг одиночной связи C−C может происходить вращение.
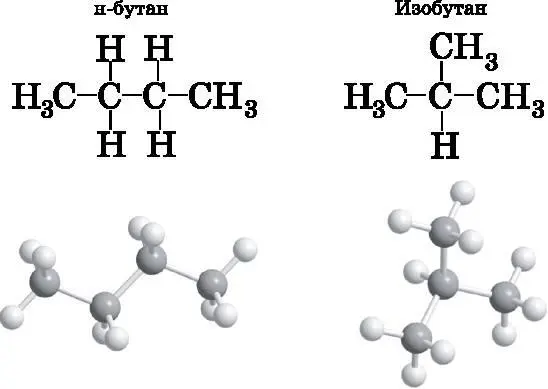
Рис. 14.12. Два структурных изомера бутана C 4 H 10 . Вверху CH 3 соответствует углероду, связанному с тремя атомами водорода. н-бутан— это линейная цепь в том смысле, что каждый атом углерода связан не более чем с двумя другими атомами углерода. Изобутан имеет разветвлённую структуру. Центральный атом углерода связан с тремя другими атомами углерода
На рис. 14.13 представлен н-бутан в двух конформациях, называемых транс и гош . Оба изображённых на рисунке конформера являются н-бутаном, поскольку атомы углерода соединены одинаковым образом. Если взять верхний конформер и выполнить поворот вокруг средней углерод-углеродной связи на 120° в направлении, указанном стрелкой, то получится гош-форма. У транс-конформера все атомы углерода лежат в одной плоскости. В гош-форме три атома углерода лежат в плоскости страницы, а четвёртый выступает над ней. В действительности существует и другая гош-форма, которая образуется путём поворота транс-формы вокруг средней C−C-связи на 120° в направлении, противоположном указанному стрелкой. В этом случае те же три атома углерода остаются в плоскости страницы, а четвёртый оказывается позади неё. Эти два гош-конформера в некотором смысле имеют одинаковую форму, но они не идентичны. Они подобны левой и правой перчаткам. Как и перчатки, эти две гош-формы нельзя совместить одну с другой. Они являются зеркальными копиями друг друга. Углеродная основа, которая может иметь левую и правую форму в зависимости от направления вращения, называется хиральной.
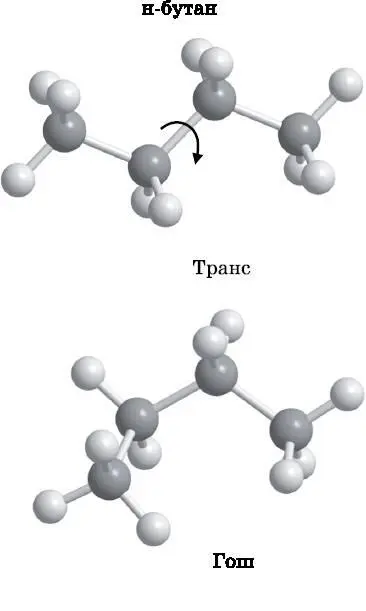
Рис. 14.13. Два конформера н-бутана. Гош-форма получается из транс-формы вращением на 120° вокруг средней C−C-связи
Вращение вокруг одиночной C−C-связи, переводящее молекулу между транс- и гош-конформациями, в жидкости при комнатной температуре может происходить очень быстро. Согласно теории, подтверждённой недавними экспериментами с ультрабыстрым инфракрасным лазером, гош-транс-переходы занимают всего 50 пс (1 пикосекунда = 10 −12 сек ), или 50 триллионных долей секунды. Поэтому в жидкости при комнатной температуре эти две формы бутана настолько быстро сменяют друг друга, что их невозможно изолировать в качестве отдельных молекул.
Двойные и тройные углерод-углеродные связи
Если вокруг одиночной C−C-связи совершить поворот очень легко, то для двойной или тройной углерод-углеродной связи это совсем не так. В главе 13 говорилось, что молекула O 2имеет двойную связь, а молекула N 2— тройную. Углерод-углеродные связи могут быть одиночными, двойными или тройными. Вращение вокруг двойной или тройной C−C-связи практически невозможно. Поэтому двойные связи могут фиксировать различные конформации молекул, имеющих одинаковые структурные изомеры. Как будет показано в главе 16, именно отсюда возникает термин «транс-жиры». Однако прежде, чем мы доберёмся до обсуждения таких больших молекул, как транс-жиры, нам надо поговорить о двойных и тройных C−C-связях.
В обсуждавшихся до сих пор соединениях углерод использует четыре sp 3-гибридизированные атомные орбитали для создания четырёх одиночных σ-связей с другими атомами. В таких соединениях каждый атом углерода имеет тетраэдрическую конфигурацию четырёх связей. На рис. 14.3 изображена молекула формальдегида. Формальдегид содержит атом углерода с двойной связью. Чтобы показать, каким образом углерод создаёт одиночные, двойные и тройные связи, мы рассмотрим химические связи в этане, этилене и ацетилене. Эти три вещества имеют химические формулы H 3C−CH 3, H 2C=CH 2и HC≡CH соответственно. Этан имеет одиночную связь, этилен — двойную, а ацетилен — тройную. На рис. 14.14 показано строение этих трёх молекул. В этане каждый атом углерода образует четыре связи в тетраэдрической конфигурации. В этилене каждый атом углерода образует три связи в форме треугольника, а в ацетилене атомы углерода образуют две связи, вытянутые в линию.
Хотя в каждой из трёх молекул два атома углерода связаны друг с другом, порядок их связи вносит большие различия. В табл. 14.1 приводятся значения длины и энергии C−C-связей для этих трёх молекул в зависимости от порядка связи. С увеличением порядка длина связи значительно сокращается, а энергия почти утраивается при переходе от одиночной связи к тройной.
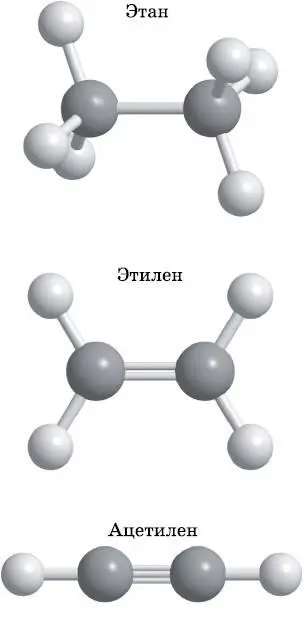
Рис. 14.14. Этан: одиночная связь, тетраэдрическая конфигурация связей углерода. Этилен: двойная связь, треугольная конфигурация связей углерода. Ацетилен: тройная связь, линейная конфигурация связей углерода
Таблица 14.1. Одиночные, двойные и тройные C−C-связи
Порядок связи, Длина связи, Энергия связи ( Дж )
Этан, Одиночная (1), 1,54Å, 5,8∙10 −19
Этилен, Двойная (2), 1,35Å, 8,7∙10 −19
Ацетилен, Тройная (3), 1,21Å, 16∙10 −19
Двойная углерод-углеродная связь — этилен
Для начала рассмотрим связь в молекуле этилена. Из рис. 14.15 видно, что углеродные центры здесь имеют треугольную форму. Как уже говорилось, для получения треугольной формы связей атом углерода будет использовать три sp 2-гибридизированные атомные орбитали для образования МО (см. рис. 14.7). Углерод имеет четыре валентные орбитали, служащие для образования химических связей: 2 s , 2 p x, 2 p yи 2 p z. В верхней части указанного рисунка молекула этилена располагается в плоскости xy . Таким образом, атомы углерода и водорода лежат в плоскости страницы, которая и есть xy . Чтобы образовать треугольную конфигурацию гибридных sp 2-орбиталей, служащих для формирования трёх связей, оба атома углерода используют 2 s -, 2 p x- и 2 p y-орбитали. С тремя гибридными sp 2-орбиталями каждый атом углерода будет создавать три σ-связи: одну — с другим атомом углерода и две — с атомами водорода. Эти σ-связи показаны в верхней части рис. 14.15.
Читать дальшеИнтервал:
Закладка:










