Ричард Фейнман - 8. Квантовая механика I
- Название:8. Квантовая механика I
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Ричард Фейнман - 8. Квантовая механика I краткое содержание
8. Квантовая механика I - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
Конечно, мы не можем сказать, на что был бы похож мир, если бы это правило — и только оно одно — изменилось; ведь оно является частью всей структуры квантовой механики, и невозможно сказать, что бы еще изменилось, если бы правило, касающееся ферми-частиц, стало бы другим. Но все же попробуем представить себе, что случилось бы, если бы переменилось только это правило. Во-первых, можно показать, что каждый атом остался бы более или менее неизменным. Начнем с атома водорода. Он заметно не изменился бы. Протон ядра был бы окружен сферически симметричным электронным облаком (фиг. 2.11, а).
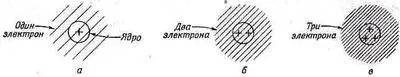
Фиг. 2.11. Так могли бы выглядеть атомы, если бы электроны вели себя как бозе-частицы.
Как мы уже писали в гл. 38 (вып. 3), хоть электрон и притягивается к центру, принцип неопределенности требует, чтобы было равновесие между концентрацией в пространстве и концентрацией по импульсу. Равновесие означает, что распределение электронов должно характеризоваться определенной энергией и протяженностью, определяющими характеристические размеры атома водорода.
Пусть теперь имеется ядро с двумя единицами заряда, например ядро гелия. Это ядро будет притягивать два электрона, и, будь они бозе-частицами, они бы, если не считать их электрического отталкивания, сплотились близ ядра как можно тесней. Атом гелия выглядел бы так, как на фиг. 2.11, б. Точно так же и атом лития, у которого ядро заряжено трехкратно, обладал бы электронным распределением, похожим на то, что изображено на фиг. 2.11, в. Каждый атом выглядел бы более или менее, как раньше: круглый шарик, все электроны в котором сидят близ ядра; не было бы никаких выделенных направлений и никаких сложностей.
Но из-за того, что электроны — это ферми-частицы, действительное положение вещей совершенно иное. Для атома водорода оно в общем-то не меняется. Единственное отличие в том, что у электрона есть спин (показан на фиг. 2.12, а стрелочкой).
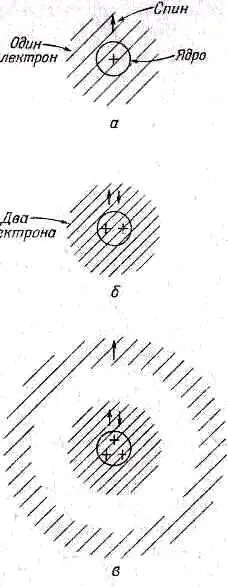
Фиг. 2.12. Атомные конфигурации, для настоящих, фермиевского типа электронов со спином. 1 / 2 .
В случае же атома гелия мы уже не сможем посадить один из электронов на другой. Впрочем, погодите, это верно лишь тогда, когда их спины направлены одинаково. Но если они разведут свои спины врозь, то они уже будут вправе занять одно и то же место. Так что атом гелия тоже не очень-то изменится. Он будет выглядеть так, как показано на фиг. 2.12, б. А вот для лития положение вещей совершенно изменится. Куда сможем мы пристроить третий электрон? Его нельзя посадить прямо на первые два, потому что оба направления спина заняты. (Вы помните, что и у электрона, и у любой частицы со спином 1/ 2имеются лишь два допустимых направления спина.) Третий электрон не сможет приблизиться к месту, оккупированному двумя другими, он обязан занять особое положение в каком-то ином состоянии, намного дальше от ядра (фиг. 2.12, в). (Мы здесь говорим обо всем довольно грубо, потому что на самом-то деле все три электрона тождественны, а раз мы не можем в действительности разобраться, кто из них кто, то наш рисунок верен только в общих чертах.)
Теперь мы уже начинаем понимать, отчего у разных атомов бывают разные химические свойства. Из-за того, что третий электрон в литии намного дальше, он связан несравненно слабее. Увести один электрон у лития куда легче, чем у гелия. (Опыт говорит, что для ионизации гелия нужно 25 в , а для ионизации лития лишь 5 в.) Это отражается на валентности атома лития. Свойства валентности, касающиеся направлений, связаны с волновой картиной внешнего электрона, но мы не будем сейчас входить в подробности. Становится понятной важность так называемого принципа запрета, утверждающего, что никакие два электрона не могут оказаться в точности в одном и том же состоянии (включая спин).
Принцип запрета несет также ответственность за крупномасштабную стабильность вещества. Мы раньше уже объясняли, что отдельные атомы вещества не обваливаются благодаря принципу неопределенности, тогда можно понять, почему не бывает так, чтобы два атома водорода прижались друг к другу сколь угодно тесно, почему все протоны не могут сойтись вплотную, образовав вокруг себя электронную тучу. Ответ, конечно, состоит в том, что поскольку в одном месте может находиться не более двух электронов с противоположными спинами, то атомы водорода вынуждены держаться поодаль друг от друга. Так что крупномасштабная стабильность вещества на самом деле есть следствие того, что электроны — это ферми-частицы. Конечно, если у двух атомов спины внешних электронов направлены в противоположные стороны, то они могут оказаться вплотную друг к другу. Именно так и возникает химическая связь. Оказывается, что два рядом стоящих атома обладают меньшей энергией, если между ними стоит электрон. Это своего рода электрическое притяжение двух положительных ядер к электрону между ними. Можно поместить пару электронов — коль скоро их спины противоположны — примерно посредине между двумя ядрами, и так возникает самая сильная из химических связей. Более сильной связи не бывает, потому что принцип запрета не позволит, чтобы в пространстве между атомами оказалось больше двух электронов. Считается, что молекула водорода выглядит примерно так, как изображено на фиг. 2.13.
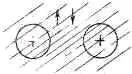
Фиг. 2.13. Молекула водорода.
Хочется сказать еще об одном следствии из принципа запрета. Вы помните, что если оба электрона в атоме гелия хотят оказаться поближе к ядру, то их спины обязательно должны смотреть навстречу друг другу. Допустим теперь, что нам бы захотелось расположить поблизости друг от друга два электрона с одним и тем же спином, скажем, приложив столь фантастически сильное магнитное поле, что спины выстроились бы в одну сторону. Но тогда два электрона не смогут занять одного положения в пространстве. Один из них вынужден будет занять другую геометрическую позицию (фиг. 2.14).

фиг. 2.14. Гелий с одним электроном в высшем энергетическом состоянии.
Более удаленный от ядра электрон будет обладать меньшей энергией связи. Поэтому энергия всего атома станет чуть выше. Иными словами, если два спина противоположны, то это приводит к намного более сильному взаимному притяжению.
Читать дальшеИнтервал:
Закладка:






![Пол Халперн - Квантовый лабиринт. Как Ричард Фейнман и Джон Уилер изменили время и реальность [litres]](/books/1082376/pol-halpern-kvantovyj-labirint-kak-richard-fejnman.webp)

