Ирина Спивак - Экология. Повреждение и репарация ДНК: учебное пособие
- Название:Экология. Повреждение и репарация ДНК: учебное пособие
- Автор:
- Жанр:
- Издательство:Array Издательство Н-Л
- Год:2006
- Город:СПб.
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Ирина Спивак - Экология. Повреждение и репарация ДНК: учебное пособие краткое содержание
В пособии описываются проблемы повреждения и репарации ДНК. Излагаются современные представления о развитии глобального ответа клетки на повреждения ДНК и рассматриваются механизмы, отвечающие за сохранение генетической стабильности организмов.
Главное внимание уделено анализу взаимосвязи и взаимозависимости трех Р ДНК-метаболизма: репликации, рекомбинации и репарации, включая биохимию, генетику и эволюцию этих процессов.
Предназначено для студентов дневной, очно-заочной, заочной форм обучения и экстернов, изучающих дисциплины «Экология» и «Физико-химические основы цитологии» в рамках подготовки бакалавров по направлению 140400 «Техническая физика».
Экология. Повреждение и репарация ДНК: учебное пособие - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
5. Эксцизионная репарация
Существуют более сложные реакции восстановления, напоминающие хирургические вмешательства в структуру ДНК, когда поврежденные участки вырезаются из цепи ДНК (отсюда происходит и термин "эксцизионная репарация", от excision – вырезание), а затем образовавшиеся бреши заполняются неповрежденным материалом. Все типы эксцизионной репарации имеют общие этапы:
1. Распознавание повреждения.
2. Надрезание нити ДНК (сахарофосфатного остова).
3. Эксцизия участка, содержащего повреждение.
4. Репаративный синтез на неповрежденной матрице и лигирование.
Три основных типа эксцизионной репарации получили свои названия в зависимости от того, какие именно повреждения будут исправляться. Эти типы репарации, несмотря на лежащий в их основе общий процесс вырезания участка ДНК с повреждением, принципиально различаются между собой.
5.1. Эксцизионная репарация оснований (base excision repair, BER)
Объектом BER служат неправильно спаренные, алкилированные, окисленные и тому подобное, основания. Как мы уже упоминали ранее, за сутки в каждой клетке человека происходит не менее 10 5нуждающихся в коррекции модификаций оснований. Этот тип повреждений не вызывает серьезных изменений в структуре двойной спирали ДНК, приводящих к нарушению репликации ДНК и остановке клеточного цикла, но служит источником мутаций. Механизм BER, возможно, является наиболее древним и важным. Первый этап распознавания поврежденных оснований в этой системе репарации осуществляют специальные белки – гоикозилазы. Это высокоспецифические ферменты, гидролизующие N-гликозидную связь между сахарофосфатным остовом и поврежденным основанием.
ДНК-гликозилазы различаются по своей субстратной специфичности, то есть они способны распознавать только определенные поврежденные основания, а не все подряд. У некоторых из них спектр распознаваемых повреждений достаточно широк, а у некоторых – крайне узок. На рис. 4 приведены различные типы повреждений оснований, которые могут распознаваться и репарироваться системой BER. Обычно определенные повреждения репарируются определенными гликозилазами.
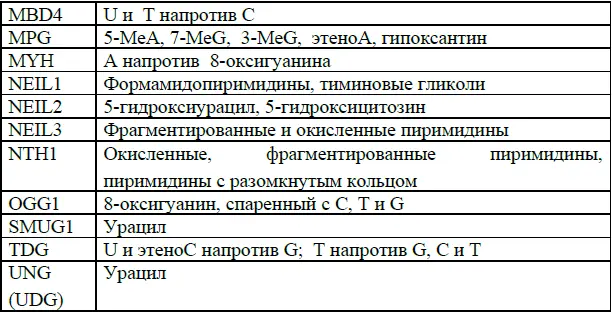
У E.coli к настоящему времени выделено и описано 8, а у человека – 11 различных гликозилаз. В табл. 2 приведены названия 11 описанных к настоящему времени гликозилаз человека и указана специфичность распознавания ими модифицированных или неправильно спаренных оснований. Обратите внимание, что ни одна из гликозилаз не распознает О 6-МеG.
Гликозилазы бывают двух типов – 1 типа убирают измененное основание, оставляя в цепи АР-сайт, а 2 типа сразу же надрезают после удаления основания АР-сайт с помощью эндогенной 3’-эндонуклеазы, оставляя после себя однонитевой разрыв. В таком случае принято указывать, что ДНК-гликозилазы 2 типа обладают не только гликозилазной, но и АР-лиазной активностью.
К ферментам 2 типа относится, например, OGG1 (8-оксогуанин-ДНК-гликозилаза эукариот) удаляющая 8-oxoG, к тому же эта гликозилаза обладает и дезоксирибофосфатазной активностью.
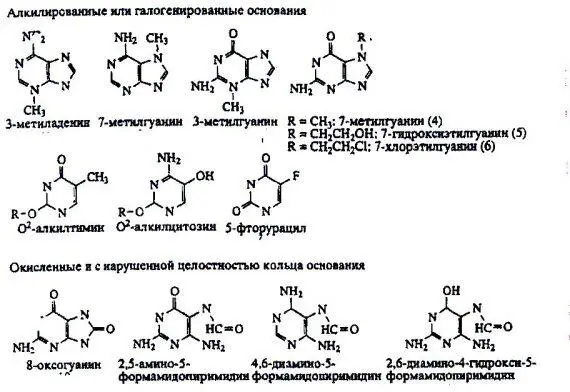
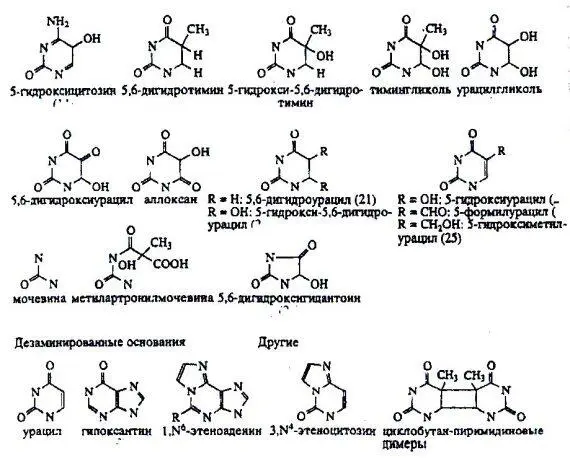
Рисунок 4. Типы повреждений оснований, репарируемые системой BER.
Здесь можно остановиться на систематике особых белков – нуклеаз. Они найдены у всех живых организмов – у бактерий, растений, животных, включая человека. Нуклеазами называют ферменты, способные расщеплять сахарофосфатную цепь. Они могут рвать эту цепь внутри полимерной молекулы ДНК или РНК, и тогда их называют эндонуклеазами, или же с концов полимеров, и тогда их называют экзонуклеазами. АР-эндонуклеазы принято делить на два класса: АР-лиазы (АР-эндонуклеазы первого типа) расщепляют связь между 3’-О-атомом дезоксирибозы и атомом фосфора. АР-эндонуклеазы второго типа осуществляют гидролиз связи между 5’-О-атомом дезоксирибозы и атомом фосфора, при этом образуется 5’-дезоксирибоза-5-фосфат и нуклеотид с 3’-гидроксильной группой. Эндонуклеазы второго типа ответственны за репарацию как спонтанно возникающих, так и АР-сайтов, образующихся в ходе гидролиза N-гликозидной связи простыми гликозилазами 1 типа без лиазной активности. Это специальные АР-эндонуклеазы APE1, APEX, Ref-1 или HAP1. АРЕ1 (AP endonuclease-1) активируется взаимодействием с белком XRCC1 и действует с ним в комплексе. О белках, называющихся XRCC (X-ray-induced damage repair cross comlementating) и их роли в различных репаративных реакциях мы поговорим позже. К настоящему времени in vitro проведена эффективная репарация неспаренных оснований U-G с возвращением к паре C: G. Реакция требовала присутствия урацил-ДНК-гликозилазы (UNG), АР-эндонуклеазы (АРЕ1), ДНК-полимеразы β (polβ) и лигазной активности, обеспечиваемой гетеродимером лигаза III/белок XRCC1. На первом этапе реакции белковая глобула UNG при связывании «покрывает» 10 пар оснований ДНК, причем каждая из этих пар взаимодействует со своим подцентром UNG, а распознаваемый урацил (то есть, собственно, связывающийся с активным центром гликозилазы) распложен на расстоянии одного-двух звеньев от 5’-конца декануклеотида, «покрытого» ферментом.
Таблица 2. Гликозилазы в клетках человека
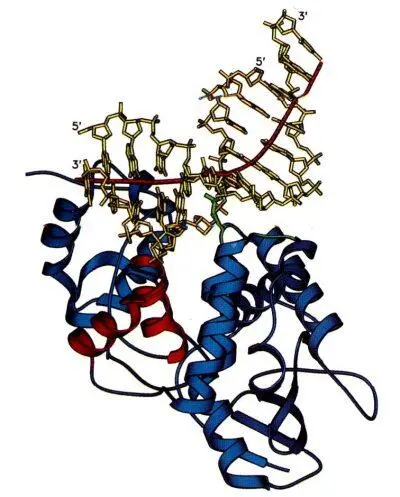
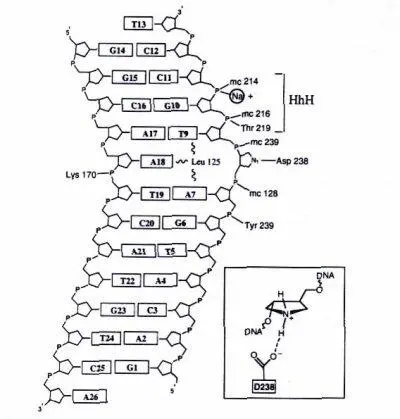
Сравнение данных структурного анализа и аминокислотных последовательностей выявляет общие черты для многих ДНК-гликозилаз. У большинства ферментов в активном центре обнаружен один и тот же повторяющийся мотив «спираль-шпилька-спираль» (Helix-hairpin-Helix, HhH). Помимо HhH-мотива в ДНК-связывающих центрах многих ферментов репарации обнаружен остаток консервативного Asp и Pro/Gly богатый район. Механизм узнавания ДНК для всех гликозилаз сходен, и активные центры этих ферментов могут связываться только с «вывернутыми» из спирали ДНК основаниями. Строение одной из гликозилаз (ALKA-1) и способ ее взаимодействия с поврежденным основанием показаны на рис. 5.
На рисунке 5а показано, как ДНК изгибается под углом 66 градусов под влиянием внедрения лейцина-125 и белковых петель αD-αE и αG-αH (показаны более сетлым). Белок заякоревается на ДНК с помощью мотива спираль-шпилька-спираль (HhH), показанного густо-серым. Локальная ось ДНК показана черным.
а
б
Рисунок 5. Схема действия ALKA-1.
а– ALKA-1-индуцированное расщепление ДНК, б– Схематическая диаграмма контакта ALKA-1 с ДНК.
Читать дальшеИнтервал:
Закладка:










