С. Егоров - Коллоидная химия. Шпаргалка
- Название:Коллоидная химия. Шпаргалка
- Автор:
- Жанр:
- Издательство:Array Литагент «Научная книга»
- Год:2009
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
С. Егоров - Коллоидная химия. Шпаргалка краткое содержание
Коллоидная химия. Шпаргалка - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
Способность катиона В 2 +адсорбироваться на данной частице выражена сильнее, чем у катиона В +. Следовательно, при относительно малой концентрации ионов В 2 +в растворе они вытеснят в раствор значительные количества ионов В +из двойного слоя.
В этом случае говорят, что ионообменное равновесие сдвинуто вправо.
Уравнение для ионного обмена, в котором участвуют данные катионы, имеет вид:
X ( В +) / X ( В 2+) = K C ( В +) / [ C ( В 2+)] 0,5,
где X(В + ) и X(В 2 + ) – количества катионов в двойном слое; C(В + ) и C(В 2 + ) – концентрация катионов в растворе.
В ионном обмене могут участвовать также ионы Н +и ОН —. Ионный обмен с участием этих ионов способен изменить реакцию среды в ту или иную сторону.
Если у коллоидных частиц обменными являются ионы водорода, то они адсорбируют из раствора содержащиеся в нем катионы. Содержание водородных ионов в результате обмена увеличивается. Такие коллоиды иначе называют ацидоидами.
Примером ацидоидаявляется коллоидная кремниевая кислота.
АH + В += АВ + Н +,
где А – точка на поверхности частицы;
В +– одновалентный катион.
Отрицательно заряженные коллоиды, которые содержат в качестве противоионов катионы металлов (например, ионы кальция), адсорбируют обменным путем ионы Н +. В этом случае происходит катионный обмен:
Х Са 2++ 2Н += Х[Н +] 2+ Са 2+.
Отрицательно заряженные коллоиды, содержащие обменные катионы металлов, связывают вводимые в раствор ионы водорода, таким способом они противодействуют подкислению среды.
Положительно заряженные коллоиды, в которых обменными являются анионы, способны адсорбировать обменным путем ионы гидроксила:
ХА + ОН —= ХОН + А —.
Коллоид при этом связывает гидроксильные ионы, тем самым он противодействует подщелачиванию среды.
На описанных свойствах основано буферное действие коллоидов.
Следует учитывать, что катионный и анионный обмен зависит от реакции среды.
Если в среде, где происходит катионный обмен, есть ионы водорода, которые также участвуют в обмене, то количество адсорбированных из раствора катионов М +будет тем меньше, чем ниже щелочность рН среды.
15. Основные методы измерения поверхностного натяжения
Поверхностное натяжение– это энергия переноса молекул из объема тела на поверхность или работа образования единицы поверхности. Существует несколько методов измерения поверхностного натяжениялегкоподвижных поверхностей раздела фаз «жидкость – газ» и «жидкость – жидкость»: статические, полустатические, динамические.
В статических методахповерхностное натяжение определяется на основе изучения равновесного состояния, к которому самопроизвольно приходит изучаемая система.
В методе Вильгельмиопределяется сила, которая необходима для уравновешивания пластинки шириной d, погруженной в жидкость; используется полностью смачиваемая жидкостью пластинка, поверхностное натяжение рассчитывается по формуле:
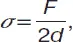
(1)
где F – сила, втягивающая пластинку в жидкость, за вычетом веса пластинки.
Метод капиллярного поднятияоснован на определении высоты столба жидкости h в капилляре радиуса r при полном смачивании; поверхностное натяжение рассчитывают по формуле:
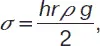
(2)
где r – плотность жидкости; g – ускорение силы тяжести.
Полустатические методыоснованы на достижении системой неустойчивого равновесного состояния. Это методы отрыва пластинки и кольца или максимального давления в пузырьке (капле).
Метод отрыва пластинки, как и метод Вильгельми, основан на определении силы, действующей со стороны жидкости на смачиваемую ею пластинку, но определение этой силы производится при отрыве пластинки от поверхности, что смягчает требования к смачиванию пластинки. Расчет поверхностного натяжения производится по формуле (1).
Метод отрыва кольца(метод дю Нуи) – один из наиболее распространенных методов определения поверхностного натяжения жидкостей. Связь поверхностного натяжения с силой F , необходимой для отрыва от поверхности жидкости тонкого кольца с радиусом R , хорошо смачиваемого жидкостью (краевой угол смачивания Θ =0°), описывают выражением:
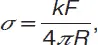
(3)
где величина k зависит от соотношения радиуса кольца и толщины проволоки, из которой сделано кольцо, и от поверхностного натяжения жидкости. Последняя зависимость слаба, что позволяет использовать этот метод как относительный:
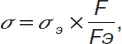
(4)
где величины s и F относятся к эталонной жидкости.
Метод максимального давленияпузырька (капли) основан на измерении максимального значения капиллярного давления, возникающего при образовании на срезе капилляра пузырька сферической формы:
Рσ = 2 σ / r 0.
Это максимальное давление определяется радиусом капилляра r 0. Метод чаще всего используется как относительный, и поверхностное натяжение исследуемой жидкости определяется по отношению значений максимальных давлений Р исследуемой и эталонной Р эжидкостей или из соотношения соответствующих высот поднятия манометрической жидкости:
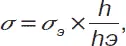
(5)
где s э – поверхностное натяжение эталонной жидкости.
16. Особенности ионного обмена в амфолитоидах, изоэлектрическое состояние амфолитоидов. Понятие об обменной емкости
Коллоиды, которые обладают свойством адсорбировать обменным путем как катионы, так и анионы, называют амфолитоидами. Частицы амфолитоидов обладают амфотерными свойствами: поверхность частицы амфолитоида, способна отщеплять ионы водорода и ионы гидроксила. Примерами амфолитоидов являются золи гидроксида алюминия и гидроксида железа (III).
Кислотные и основные свойства амфолитоидов выражены в различной степени: кислотные свойства могут преобладать над основными, или, наоборот, основные свойства преобладают над кислотными. Доминирование кислотных свойств амфолитоида проявляется в том, что в нейтральной среде с поверхности коллоидной частицы ионы водорода переходят в окружающий раствор в большем количестве, чем ионы гидроксила.
Читать дальшеИнтервал:
Закладка:









