Сергей Белопухов - Физическая и коллоидная химия. Основные термины и определения. Учебное пособие
- Название:Физическая и коллоидная химия. Основные термины и определения. Учебное пособие
- Автор:
- Жанр:
- Издательство:Литагент Проспект (без drm)
- Год:2015
- ISBN:9785392199785
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Сергей Белопухов - Физическая и коллоидная химия. Основные термины и определения. Учебное пособие краткое содержание
Физическая и коллоидная химия. Основные термины и определения. Учебное пособие - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
∆ U = Q – A ,
где Q – теплота (Дж), А – работа (Дж).
Вода.Химическое вещество состава Н 2О. Самое распространенное химическое соединение на нашей планете, уникальный растворитель. Молекула воды имеет симметричную нелинейную структуру. Связь Н‒О ковалентная полярная, угол Н‒О‒Н равен 104,5°, между молекулами воды существует водородная связь . Вода обладает целым рядом аномальных физических свойств, что объясняется в первую очередь наличием водородных связей. Физические свойства: Т кип.= 100 °C, Т пл.= 0 °C при атмосферном давлении. При комнатной температуре вода – жидкость без вкуса, цвета и запаха, прозрачная, плотностью 1 г/см 3. Чистая вода является слабым электролитом. Различают ионное произведение воды: произведение концентраций ионов водорода и гидроксила не только в воде, но и в любом водном растворе есть величина постоянная при постоянной температуре. Пример: при 22 °C концентрация ионов водорода в чистой воде равна концентрации гидроксил-ионов и равна соответственно 10 –7г-ион на литр. Следовательно, можно записать: С Н× С ОН= 10 –7× 10 –7= 10 –14.
Водородная связь.Вторая, побочная валентность атома водорода, которая проявляется по отношению к сильно отрицательным атомам, если основной валентностью он связан с атомом, наиболее сильно отрицательным в данной молекуле.
Водородный показатель рН.Величина, характеризующая концентрацию (активность) ионов водорода в растворе, численно равна отрицательному десятичному логарифму концентрации (активности) ионов водорода, выраженной в моль на литр. В разбавленных водных растворах 0 ≤ рН ≤ 14. В кислых растворах 0 ≤ рН ≤ 7. В нейтральных растворах рН = 7. В щелочных растворах 7 ≤ рН ≤ 14.
Для расчета рН в разбавленных растворах различных классов соединений используют следующие уравнения:
Сильные кислоты: рН = – lga H+.
Сильные основания: pH = 14 – pOH
Слабые кислоты: pH = ½(pK к– lgC)
Слабые основания: pH = 14 – ½pK о+ ½lgC
Гидролитически кислые соли: pH = 7 – ½pK осн– ½lgC
Гидролитически щелочные соли: pH = 7 + ½pK кисл+ ½lgC
Буферные растворы: pH = pK a+ lg[соль] – lg[кислота]
рH = pK a+ lg[основание] – lg[соль].
Возгонка(сублимация). Превращение твердого вещества в газообразное без процесса плавления – например, возгонка йода.
Воспроизводимость.Повторяемость результатов анализа одного и того же элемента (вещества), полученная по данным нескольких экспериментов. Воспроизводимость характеризует рассеяние единичных результатов относительно среднего, т. е. степень близости друг к другу результатов единичных определений. Под воспроизводимостью также понимают рассеяние результатов химического анализа, полученных в разных лабораториях, в разное время и т. д. Воспроизводимость зависит от подготовки пробы для анализа.
Восстановитель.Атом, молекула или ион, который отдает электроны в окислительно-восстановительных реакциях. Примеры: Zn – 2e —= Zn 2+, Zn – восстановитель; 2Сl —– 2е —= Сl 2, Сl —– восстановитель.
Восстановление.Процесс присоединения электронов атомом, молекулой или ионом. Наблюдается в окислительно-восстановительных реакциях. Примеры: S + 2e —= S 2–– восстановление серы до сульфида; MnO 4 —+ 8H ++ 5e —= Mn 2++ 4Н 2О – восстановление марганца от степени окисления +7 до степени окисления +2.
Время релаксации ионной атмосферы.Время, за которое ионная атмосфера образуется на новом месте и исчезает на старом.
Второе начало термодинамики(второй закон термодинамики)
– формулировка Клаузиуса.Теплота не может самопроизвольно переходить от менее нагретого тела к более нагретому.
– формулировка Кельвина и Планка.Невозможно построить периодически действующую машину, единственным результатом действия которой было бы совершение механической работы за счет охлаждения теплового резервуара.
Математическое выражение второго начала термодинамики:

где Q обрили Q необр– полное количество тепловой энергии, выделенной или поглощенной системой; S – энтропия.
Высаливание.Выпадение растворенного высокомолекулярного соединения в осадок при определенной концентрации добавляемого электролита.
Высокомолекулярные соединения (ВМС).Соединения органической природы, молекулярная масса которых от нескольких тысяч до нескольких миллионов. ВМС образуют при смешивании с растворителем молекулярные растворы , подобные обычным растворам низкомолекулярных веществ, но с очень длинными цепными молекулами. Такие растворы относятся к однофазным (гомогенным) системам. Как и растворы сахара или мочевины, они образуются самопроизвольно, потому что сам процесс растворения идет с уменьшением свободной энергии и не требует наличия стабилизатора. Растворы ВМС оказываются вполне устойчивыми, независимо от длительности существования. Они являются молекулярными термодинамически равновесными системами, и поэтому обратимы. Вследствие наличия длинных молекулярных цепей ВМС отличаются по ряду свойств от растворов низкомолекулярных веществ и проявляют свойства высокодисперсных гетерогенных систем. К ВМС относятся натуральный и искусственный шелк, шерсть, хлопок, лен, синтетические смолы, пластические массы, натуральный и синтетический каучуки, синтетические волокна – капрон, нитрон, лавсан и др., а также белковые вещества, крахмал, целлюлоза, ее производные и многие другие.
Высокопроводящие материалы.Наноматериалы, которые разрабатываются в настоящее время с использованием нанотехнологий. Например, электрические кабели, сделанные из нанотрубок, при комнатной температуре будут иметь электропроводность на два порядка выше, чем медные кабели.
Вязкость.Внутреннее трение жидкости, возникающее при истечении одного слоя относительно другого. Единицы вязкости: в системе СИ – паскаль × секунда (Па × с); в системе СГС— пуаз (П). 1 Па × с = 10 П.
Вязкость относительная– отношение вязкости раствора полимера η рк вязкости растворителя η 0:
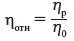
Вязкость удельнаяотражает возрастание относительной вязкости по сравнению с единицей:
η уд= η отн– 1
Вязкость приведеннаяучитывает влияние концентрации раствора на вязкость, т. е. оценивает, насколько велика удельная вязкость, отнесенная к единице концентрации растворенного вещества:
Читать дальшеИнтервал:
Закладка: