Юрий Иванов - На суше и на море. 1974. Выпуск 14
- Название:На суше и на море. 1974. Выпуск 14
- Автор:
- Жанр:
- Издательство:Мысль
- Год:1974
- Город:Москва
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Юрий Иванов - На суше и на море. 1974. Выпуск 14 краткое содержание
В сборник включены приключенческие повести, рассказы и очерки о природе и людях нашей Родины и зарубежных стран, о путешествиях и исследованиях советских и иностранных ученых, фантастические рассказы. В разделе «Факты. Догадки. Случаи…» помещены научно-популярные статьи и краткие сообщения по различным отраслям наук о Земле.
На суше и на море. 1974. Выпуск 14 - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
Некоторые зарубежные ученые говорили даже о том, что уже в начале 70-х годов нашего века он потеплеет настолько, что начнется переселение в Европу африканских животных. Однако этого, как мы теперь видим, не случилось. Интересно и другое. Ежегодное поступление углекислого газа, судя по количеству сжигаемого топлива, в четыре раза больше (10 10 т), чем рост концентрации СО 2в атмосфере, по данным измерений. Куда же девается большая часть углекислого газа?
Ученые давно уже пришли к выводу, что основным регулятором концентрации атмосферной углекислоты служит океан. В нем содержится углекислого газа примерно в 100 раз больше, чем в атмосфере. Дело в том, что растворимость СО 2в воде во много раз выше, чем других газов атмосферы, в том числе кислорода и азота. Растворение газов в жидкости — процесс обратимый. Поглощенные водой молекулы газа находятся в непрерывном тепловом движении, их кинетическая энергия тем выше, чем выше температура воды. Энергия некоторых молекул растворенного газа столь велика, что им удается «вырваться» из раствора, и они снова переходят в воздух. Устанавливается динамическое равновесие между поступлением газа из воздуха в раствор и из раствора в воздух, при этом концентрация растворенного газа прямо пропорциональна концентрации его в воздухе (точнее, давлению, поскольку каждый газ ведет себя так, словно образует независимую атмосферу). Это правило растворимости, пропорциональной давлению, называется законом Генри.
Растворимость газов зависит и от температуры воды. Но здесь речь идет об очень небольших изменениях средней температуры — на 2–5°, которые мало влияют на растворимость газов, но способны дать начальный толчок к изменению климата Земли. При составлении точных математических моделей температурная поправка к закону Генри учитывается.
Если концентрация в атмосфере (и, значит, давление) какого-то газа, например углекислого, окажется выше величины, определяемой законом Генри, то океан поглотит большую часть этого избытка. Если же, наоборот, содержание газа в атмосфере понизится, то из океана поступит определенная порция этого газа.
Однако часть молекул углекислого газа успевает вступить в химическую реакцию с водой, образуя угольную кислоту. Кислота остается в растворе и сама претерпевает дальнейшие химические изменения. Вот поэтому-то растворимость углекислого газа намного больше, чем азота и кислорода, а также благородных газов, которые химически не взаимодействуют с водой. При 0° литр морской воды может поглотить из атмосферы 50 см 3 углекислого газа, а кислорода — только 8 см 3, а ведь в атмосфере давление первого составляет 0,23 мм, а второго — 158,8 мм ртутного столба.
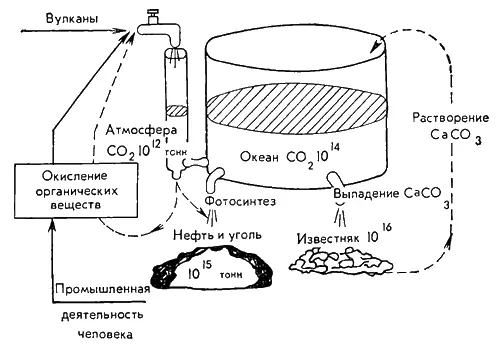
В действительности способность океана поглощать из атмосферы избыточную углекислоту еще выше. Говоря о растворении газов, мы невольно уподобляли океан стакану с водой. Более правильно сравнить с бассейном, который имеет входы и выходы. Этот бассейн соединен с атмосферным резервуаром углекислоты по принципу сообщающихся сосудов, причем первый из этих сосудов в сто раз больше, чем второй. Через один из входов в бассейн, как показано на рисунке, происходит обмен углекислым газом между океаном и атмосферой, причем преимущественно поступление его в океан, а через другой — обмен (преимущественно отвод) благодаря химическим и биохимическим реакциям в океане. Химический канал такой транспортировки углекислого газа представляет собой систему последовательных обратимых (как и процесс растворения) реакций, включающих распад угольной кислоты на ионы водорода и бикарбонатионы (НСО - 3), а последних — снова на ионы водорода и карбонат-ионы (СО 2- 3). Ионы СО 2- 3связываются ионами кальция в нерастворимый СаС0 3, оседающий на дно океана и образующий известковые породы.
Благодаря осаждению СаС0 3на протяжении миллионов лет осуществляется перекачивание СО 2из океана и через океан из атмосферы в донные отложения — известняк. За историю Земли его отложилось в десять тысяч раз больше, чем сейчас СО 2в атмосфере. Такое же направление потока и биологического канала транспортировки СО 2. Фотосинтезирующие организмы потребляют углекислоту, создавая органическое вещество, которое включается через пищевые блоки в биомассу всех организмов океана, заключающую в себе 3х10 10 т СО 2. Отмершие организмы, или, как их называют океанологи, детрит, оседают на дно океана, превращаясь со временем в ископаемый уголь и нефть. Количество этих ископаемых в тысячу раз больше содержания в атмосфере углекислого газа, из которого они в конечном счете образовались. Интенсивность биологического потока, выводящего углекислый газ из атмосферы и в значительной степени из круговорота его в природе вообще, очень велика: за 300–400 лет (ничтожный срок в геологических масштабах!) организмы потребляют такое же количество углекислоты, какое содержится во всей атмосфере.
Оба потока, регулирующие кон-цен грацию СО 2, составляют равновесную систему и состоят из последовательных звеньев, содержащих различные химические формы углерода. Нельзя изменить концентрацию углерода ни в одном звене без того, чтобы не вызвать ее изменений во всех остальных звеньях, что приводит к новому состоянию равновесия.
Проследим за этой взаимосвязью в биологическом потоке. Если концентрация СО 2в атмосфере повысится, значительная часть углекислого газа поглотится по закону Генри морской водой. Но из-за повышения концентрации углекислого газа в морской воде возрастет его потребление организмами, а так как должно соблюдаться равновесное соотношение СО 2в океане и атмосфере, то океан поглотит дополнительное количество углекислого газа и т. д. Эта волна интенсификации потока пройдет до самого конца цепочки — до увеличения количества отмерших организмов (детрита), попадающих за год на дно океана: равновесная система реагирует на внешнее изменение так, чтобы ослабить проявление этого изменения.
Для наглядного представления о природной системе автоматического регулирования вернемся к рисунку с сообщающимися сосудами. Стрелками, устремленными к крану, отмечены процессы, приводящие к поступлению СО 2в атмосферу. Это вулканическая деятельность, химическое и биологическое окисление содержащих углерод веществ в природных условиях, наконец, работа промышленных предприятий.
Все, что показано на рисунке, можно построить в виде модели, в которой запасы и потоки углерода или углекислого газа будут заменены объемами и потоками воды. Такие модели называют гидродинамическими. До последнего времени их успешно использовали в научных исследованиях и технических расчетах, пока на сцепе не появились быстродействующие электронно-вычислительные машины. Но гидродинамические модели помогают наглядно представить сложные процессы. Сейчас такая модель нам пригодится, чтобы выяснить, почему океан регулирует содержание СО 2в атмосфере, хотя существует и обратное влияние атмосферы на содержание углекислоты в океане.
Читать дальшеИнтервал:
Закладка:










