Михаил Бармин - Общая и Неорганическая химия с примерами решения задач
- Название:Общая и Неорганическая химия с примерами решения задач
- Автор:
- Жанр:
- Издательство:Литагент Selfpub.ru (искл)
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Михаил Бармин - Общая и Неорганическая химия с примерами решения задач краткое содержание
Общая и Неорганическая химия с примерами решения задач - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
I. Все вещества в природе состоят из частичек, физически неделимых и обладающих способностью взаимного сцепления.
II. Свойства веществ зависят от свойств этих элементов. (Мелкие элементы – атомы, корпускулы – молекулы).
III. Причина различия веществ не только в составе корпускул, но и в различном расположении элементов в корпускуле.
IV. Корпускулы движутся согласно законам механики. Так как изменения веществ обуславливаются движением корпускул, то химические превращения должны изучаться методами физики и математики.
Стехиометрия – раздел химии, в котором рассматриваются весовые и объемные отношения между реагирующими веществами.
XVIII–XIX вв. Основные стехиометрические законы.
Закон Дальтона
Р = P1+P2+P3+… , где Р – общее давление; P1,2,3… –пар-
циальное давление газов
Закон Авогадро: в равных объемах разных газов при оди-наковых условиях (P,V) cодержится одинаковое число частиц (молекул или атомов)
Na –число Авогадро ; Na= 6,02–1023
При Н.У. 1моль любого газа занимает V=22,4л
mx = nMx = Д
m1 nM1 х/1


3. Mx = Дх/1M1
Закон Бойля–Мариотта Т – const
P1 V1 = P2V2
Закон Шарля и Гей–Люссака
P – const ;
V = T
V0 T0

Объединенный закон газового состояния для 1 моля газа
PV P0V0
T = T0 = R
Т0=273,15К V0=22,4 л P0=101325 Па=760мм рт.ст.
Уравнение Менделеева– Клапейрона(1874г.) PV= nRT = mМ 
 *RT
*RT

Где R–универсальная газовая постоянная=8,31 Дж/моль К= 8,314 Па =0,082 атм л/(моль К) = 62360 мм рт.ст мл/(моль К)
Закон сохранения массы: Ломоносов(1748), Лавуазье(1774)
Σ m(продуктов) = Σ m (исходных)
«Что и где убыло, то именно в другом месте и присовокупиться должно, но в той же мере».
Закон простых объемных отношений
(Гей–Люссака, 1808г)
H2 + Cl2 = 2HCl
Объемы вступающих в реакцию газов относятся между собой и к объему образующихся продуктов как небольшие целые числа.
Закон эквивалентов
m1 = Э1
m2 Э2
Э(х)=f(х)М(х),
где f(x) – фактор Х, который показ., какая доля этой частицы устанавливает 1 новую хим. связь, например, для Al+3
f(x) = 1/3
Э(х)= M(x)/3
Массы веществ взаимодействуют пропорционально их эквивалентам, или один эквивалент одного вещества взаимодействует с одним эквивалентом другого вещества.
Закон постоянства состава 1801–1807г Пруст:
Всякое чистое в–во имеет количественный и качественный состав независимо от способов его получения.
Закон кратных соотношений 1803 г. Дальтон:
Если 2 элемента образуют между собой ряд соединений, то масса одного элемента, приходящаяся на одну и ту же массу другого элемента, относятся как небольшие целые числа.
Закон сохранения массы и энергии Эйнштейна (1905 г.)
Е=mc2,
m – масса – мера энергии, Е – мера движения вещества
Девиз: «АТОМ НЕИСЧЕРПАЕМ
ТАК ЖЕ КАК ВСЕЛЕННАЯ»
ЛЕКЦИЯ 2
СТРОЕНИЕ АТОМА
План лекции
1.Строение атома (история вопроса).
2.Значение теории Бора.
3.Энергетические состояния электрона в атоме.
Атом – в переводе с греческого – неделимый. Понятие введено Демокритом как мельчайший кирпичик мироздания (V век до н.э.). Считалось, что атомы неделимы, т.е. не содержат более простых составных частей и не могут превратиться в атом другого элемента.
В конце XIX века установлен ряд фактов, свидетельствую-+98.юбщих о сложном составе атома и о возможности их взаимопревращений.
1896 г. Явление радиоактивности (Р) (radius – луч, с латинского) обнаружил у соединений урана французский физик А.Беккерель.
Р – явление испускания некоторыми элементами излуче-ния, способного проникать через вещества, ионизировать воз-дух, вызывать почернение фотопластинок.
1897 г. Английский физик Дж.Дж.Томсон открыл электрон – элементарную частицу, обладающую наименьшим существую-щим в природе отрицательным электрическим зарядом 1,6–10 -19 Кл. Масса 9,1–10-28 г., в 2000 раз меньше атома водорода.
1898 г. Мария Кюри-Склодовская и Пьер Кюри в составе урановых руд открыли 2 новых радиоактивных элемента – ПОЛОНИЙ (Polonia –Польша) и радий, которые оказались более мощными источниками радиоактивного излучения, чем уран и торий. Супруги Кюри и Э.Резерфорд установили неоднородность радиоактивного излучения: под действием магнитного поля оно разделяется на три пучка один из которых не изменяет первоначального направления, а два другие отклоняются в противоположном направлении. Не отклоняющиеся –γ–лучи – жесткое электромагнитное излучение, сходное с рентгеновскими лучами и обладающие очень большой про-никающей способностью. Отклонение других пучков под действием магнитного поля говорили о наличии электрически заэхряженных частиц.
Противоположные направления отклонений говорят о раз-ных зарядах. β –лучи – поток быстро движущихся электронов, а α –лучи дважды ионизированные атомы Не 2+.
Опытом Резерфорд доказал, что α-частицы – Не 2+, и что при распаде образуется Rn –радон (RaНе 2+→ Rn). Изучение радиоактивности подтвердило сложность состава атомов и возможность перехода из атома одного элемента в атомы другого элемента.
1903 г. Дж.Дж.Томсон – атом состоит из положительного за-ряда, равномерно распределенного по всему объему атома, и электронов колеблющихся внутри этого заряда.
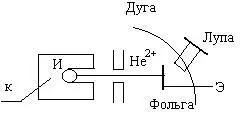
Опыт Э.Резерфорда
И–источник α излучения; К–свинцовый кубик с каналом; Э–экран, – покрытый ZnS
Этот опыт заключался в бомбардировке тонкого слоя како-го-либо вещества, в частности, металлической фольги, пучком быстро движущихся α-частиц и наблюдении, в каком направлении α-частицы рассеиваются атомами.
Сущность опыта заключается в следующем. Кусочек радия, помещенный в камеру из свинца, испускает α-частицы. Не-большое отверстие в свинцовом блоке формирует пучок α-частиц. Этот пучок проходит затем через металлическую фольгу, и прослеживаются направления, в которых α-частицы продол-жают свое движение. Направление движение можно устано-вить, применяя экран, покрытый сульфидом цинка; при ударе α-частицы о такой экран на нем появляется вспышка.
Если бы атомы, бомбардируемые α-частицами, представ-ляли бы собой плотные образования, состоящие из переме-шанных положительных и отрицательных зарядов, то все они должны были бы в какой-то мере изменить направление своего движения. Однако в действительности большинство α-частиц проходит через фольгу без отклонения.
В одном из опытов α-частицы проходили через золотую фольгу толщиной 400 нм и проникали через 1000 слоев атомов, и всего лишь одна частица из 100000 отклонялась от первона-чального направления. Это частица отклонялась очень сильно, более чем на 90°. Когда брали фольгу вдвое толще, то оказыва-лось, что примерно вдвое большее число α-частиц отклонялось под большими углами, тогда как подавляющее большинство по-прежнему проходило через фольгу без отклонения.
Читать дальшеИнтервал:
Закладка:










