Михаил Бармин - Общая и Неорганическая химия с примерами решения задач
- Название:Общая и Неорганическая химия с примерами решения задач
- Автор:
- Жанр:
- Издательство:Литагент Selfpub.ru (искл)
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Михаил Бармин - Общая и Неорганическая химия с примерами решения задач краткое содержание
Общая и Неорганическая химия с примерами решения задач - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
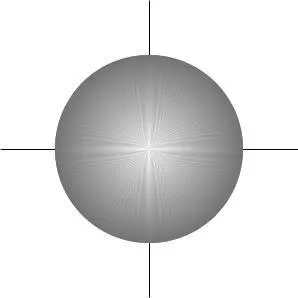
ПЛОТНОСТЬ ЭЛЕКТРОННОГО
ОБЛАКА ПРОПОРЦИОНАЛЬНА
КВАДРАТУ ВОЛНОВОЙ ФУНКЦИИ.
ЭНЕРГЕТИЧЕСКОЕ СОСТОЯНИЕ
ЭЛЕКТРОНА В АТОМЕ
Для электрона, находящегося под действием сил притяжения к ЯДРУ, уравнение ШРЕДИНГЕРА имеет решения не прилюбых, а только определенных значениях энергии. Поэтому квантованность энергетических состояний электрона в атоме (т.е. первый постулат Бора) оказывается следствием присущих электрону волновых свойств и не требует особых постулатов.
Рассматривая как модель одномерный атом со стоячими волнами де Бройля найдем Е=mv2/2= h2n2/8ml2 и стоячая волна λ=2l/m λ=h/mv → V=hn/2ml
ДОПУСТИМЫЕ УРОВНИ ЭНЕРГИИ ЭЛЕКТРОНА ОПРЕДЕЛЯЮТСЯ ЗНАЧЕНИЕМ ЦЕЛОГО ЧИСЛА n, ПОЛУЧИВШЕГО НАЗВАНИЕ ГЛАВНОГО КВАНТОВОГО ЧИСЛА (N (n) = 1 – ∞, в пределах таблицы = 7).
Решение уравнения Шредингера для реального атома также приводит к выводу о квантованности энергетических состояний электрона в атоме. Становится ясным и вопрос о состоянии электрона при переходе из одного стационарного состояния в другое (второй постулат). При переходе из одного стационарного состояния в другое (во время перехода) длина волны будет иметь переменное значение, не отвечающее условию образования стоячей волны (неустойчивое состояние) и оно будет меняться до устойчивого состояния (стоячая волна), т.е. электрон окажется в новом состоянии.
В однородной модели атома положение электрона относительно ядра определяется одной координатой, а его состояние – значением главного квантового числа; в двухмерной – двумя – числами; в трехмерный –тремя квантовыми числами. В реальных атомах электрон обладает еще одной квантованной физической характеристикой – СПИНОМ.
Таким образом, для описания состояния электрон в реальном атоме необходимо указать значения 4-х квантовых чисел.
Энергия электрона может принимать только определенные значения – квантована. Энергия реального атома тоже.
N(n) – главное квантовое число – определяет возможные энергетические состояния электрона в атоме. Принимает зна-чения 1, 2, 3, … 7, ∞. Состояние электрона характеризующееся определенным значением N – энергетический уровень (номер периода).
N– определяет и размеры электронного облака. Большим размерам электронного облака соответствует более высокая энергия электрона в атоме и большее значение n. Электроны характеризующиеся одним и тем же значением n, образуют в
атоме электронного облака приблизительно одинаковых размеров; поэтому можно говорить о существовании ЭЛЕКТРОННЫХ СЛОЕВ ИЛИ ЭЛЕКТРОННЫХ ОБОЛОЧЕК
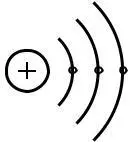

l – ОРБИТАЛЬНОЕ КВАНТОВОЕ ЧИСЛО (ПОБОЧНОЕ, АЗИМУТАЛЬНОЕ) ФОРМА ЭЛЕКТРОННОГО облака определяется l. l – квантовано и имеет целочисленное значение от 0 до n– 1. Физический смысл l – определяет значение орбитального момента количества движения электрона:
M=mVr M ┴ плоскости V и r
В многоэлектронных атомах энергия электрона зависит и от l (кроме n), поэтому состояния электрона, характеризующиеся различными значениями l называются ЭНЕРГЕТИЧЕСКИ-
МИ ПОДУРОВНЯМИ
Орбитальное квантовое число l обозначается цифрами 1, 2,
3, 4, 5 (S P d f g h).
Соответственно S, P, d, f, g, h – электроны (или семейства). Электронное облако 1S –электрона обладает сферической
симметрией.
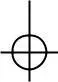
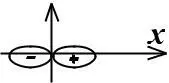
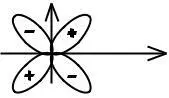
1s – электроны 2р – электроны 3d – электроны
ml – МАГНИТНОЕ КВАНТОВОЕ ЧИСЛО
Из уравнения Шредингера следует, что и ориентация электронного облака в пространстве не может быть произвольной: ml – определяется значениями +l, 0-l.
Всего 2l+1 значений магнитного квантового числа, т.е. 2l+1 возможных расположений электронного облака в пространстве.
СОСТОЯНИЕ ЭЛЕКТРОНА В АТОМЕ ХАРАКТЕРИЗУЮЩЕЕСЯ, ОПРЕДЕЛЕННЫМИ ЗНАЧЕНИЯМИ КВАНТОВЫХ ЧИСЕЛ n, l,m. т.е. определенными размерами, формой и ориентацией в пространстве Э. облака – атомная электронная орбиталь.
S – СПИНОВОЕ КВАНТОВОЕ ЧИСЛО
spin – кручение, вращение) характеризующее собственное состояние электрона. Значения +1/2, –1/2. Таким образом, зна-чения квантованы и различаются на 1. Упрощенно понимают как вращение вокруг собственной оси. Проекция собственного момента количества движения электрона на избранное направление (на ось Z) и называется СПИНОМ.
В многоэлектронных атомах на каждый электрон действует не только ядро, но и вcе остальные электроны. При этом электроны облака отдельных электронов как бы сливаются в одно общее многоэлектронное облако. Точное решение уравнения Шредингера для таких сложных систем недостижимо.
Электронная структура атомов и периодическая система.
ПРИНЦИП ПАУЛИ (ЗАПРЕТ ПАУЛИ). В атоме не может быть двух электронов, у которых все четыре квантовых числа были бы одинаковыми.
Из этого следует, что каждая атомная орбиталь, характеризующаяся определенными значениями n, l, m может быть занята не более чем двумя электронами, спины которых имеют противоположные знаки. Такие электроны – спаренные. l=0, m= 0. Следовательно на S –подуровне имеется всего 1 орбиталь (S) (квантовая ячейка).
По принципу Паули, при l=1(Р) m =+1, 0, – 1, по 2 эл. с разными спинами. Итого: 6 электронов.
l = 2
m = 5
по 2 = 10 электронов,
l = 3
m = 7
по 2 = 14 электронов,
l = 4
m = 9
по 2 = 18 электронов.
ПРАВИЛО ХУНДА.
Устойчивому состоянию атома соответствует такое распределение электронов в пределах энергетического подуровня, при котором абсолютное значение суммарного спина атома максимально.
ПЕРВОЕ ПРАВИЛО КЛЕЧКОВСКОГО.
При увеличении заряда ядра атома последовательное запол-нение электронных орбиталей происходит от орбиталей с меньшим значением суммы главного и орбитального квантовых чисел (n+l) к орбиталям с большим значением этой суммы.
ВТОРОЕ ПРАВИЛО КЛЕЧКОВСКОГО.
При одинаковых значениях n+l заполнение орбиталей происходит последовательно в направлении возрастания главного квантового числа
Правило Клечковского не для всех атомов описыва-
ет правильно электронную конфигурацию. Например 24Cr 1S22S22P63S23P64S23d4 (должно быть), 4S'3d5 (на самом деле).
Это явление называется «провал электронов» и объясняется тем, что более устойчивым атом является тогда, когда число ē на d-орбитали приближается к 5 или 10. В этом случае и происходит переход e c S – на d. –орбиталь.
Читать дальшеИнтервал:
Закладка:










