Михаил Бармин - Общая и Неорганическая химия с примерами решения задач
- Название:Общая и Неорганическая химия с примерами решения задач
- Автор:
- Жанр:
- Издательство:Литагент Selfpub.ru (искл)
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Михаил Бармин - Общая и Неорганическая химия с примерами решения задач краткое содержание
Общая и Неорганическая химия с примерами решения задач - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
IY. Современная формулировка периодического закона, объяснение явления периодичности с точки зрения теории строения атома.
Периодический закон Д.И. Менделеева и высказанные на его основе гипотезы явились стимулом к выяснению строения атома.
В начале ХХ века была создана теория строения атома, на основе которой периодический закон Д.И. Менделеева формулируется так:
«Свойства химических элементов и образуемых ими простых и сложных веществ находятся в периодической зависимости от величины заряда ядра атомов этих элементов».
Было выяснено, что порядковый номер химического элемента совпадает с зарядом ядра его атома.
На основе знания теории строения атома сущность явления периодичности объясняется тем, что с возрастанием заряда ядра атомов элементов наблюдается периодическая повторяемость элементов с одинаковым числом валентных элементов, чем объясняется периодическая повторяемость свойств химических элементов и их соединений.
Расположение электронов объясняется теорией строения атомного ядра. В свете учения о строении атомного ядра следует объяснить положение водорода в периодической системе. Атом водорода имеет один внешний электрон, который он может отдавать атомам других элементов. Подобное свойство проявляют атомы всех элементов, начинающих период: Li, Na, K, Pb, Cs, Fr. Поэтому водород Н, проявляющий металлические свойства (отдача электронов), должен находиться в главной подгруппе 1-й группы.
С другой стороны, поскольку на первом уровне от ядра может 2 электрона, водород может принимать один электрон подобно тому, как принимает его каждый атом галогенов:
+ е = Н–
этом случае водород проявляет неметаллические свойства
должен находиться в главной подгруппе VII группы. Двойс-твенность в химическом поведении водорода дает возможность отнести его прежде всего к главной подгруппе I группы и затем к главной подгруппе VII группы (в этом случае символ элемен-та заключается в скобки). Однако часто водород ставят только в I группе, поскольку он начинает период.
Y. Значение периодического закона и периодической системы химических элементов, применение ее для выяснения физических и химических свойств элементов, получения новых элементов.
Периодический закон Д.И. Менделеева имеет исключительно большое значение. Он положил начало современной химии, сделал ее единой, целостной наукой. Элементы стали рассматриваться во взаимосвязи, в зависимости от того, какое место они занимают в периодической системе. Как указывал Н. Д. Зелинский, периодический закон явился «открытием взаимной связи всех атомов мироздания».
Химия перестала быть описательной наукой. С открытием периодического закона в ней стало возможным научное предвидение. Появилась возможность предсказывать и описывать новые элементы и их соединения.
На основе закона Д.И. Менделеева были заполнены все клетки его системы от элемента с Z=1 до Z=92, а также открыты трансурановые элементы. И сегодня этот закон служит ориентиром для открытия или искусственного создания новых химических элементов (ивзестно 116 элементов).
Периодический закон послужил основой для исправления атомных масс элементов. У 20 элементов Д.И. Менделеевым были исправлены атомные массы, после чего эти элементы заняли свои места в периодической системе.
На основе периодического закона и периодической системы быстро развивалось учение о строении атома. Оно вскрыло физический смысл периодического закона и объяснило положение элементов в периодической системе.
Учение о строении атома привело к открытию атомной энергии и использованию ее для нужд человека. Можно без преувеличения сказать, что периодический закон является первоисточником всех открытий химии и физики ХХ века. Он сыграл выдающуюся роль в развитии других, смежных с химией естественных наук.
Периодический закон и система элементов лежат в основе решения современных задач химической науки и промышленности. С учетом периодической системы элементов Д.И. Менделеева ведутся работы по получению новых полимерных и полупроводниковых материалов, жаропрочных сплавов, веществ с заданными свойствами, по использованию ядерной энергии, исследуются недра Земли и Вселенная.
Девиз: «ВЗАИМОДЕЙСТВУЮТ
АНТИПОДЫ»
ЛЕКЦИЯ 4
ХИМИЧЕСКАЯ СВЯЗЬ
План лекции:
Теории Косселя и Льюиса.
Метод валентных связей (ВС) и молекулярных орбиталей
(МО).
Свойства связей.
Металлическая связь.
Водородная связь.
Вопрос о химической связи является одним из фундаментальных в химии. Первая теория – Берцелиуса – электростатическая. Вещества связаны посредством притяжения разноименно заряженных частиц.
Однако, не все химические соединения можно объяснить с позиций этой теории: H 2, Cl 2и т.д. (H +,H –). Органические соединения также не укладывались в рамки этой теории.
Теории, базирующиеся на электронном строении были предложены Косселем и Льюисом.
Положения. При формировании электронных оболочек в конце каждого периода реализуется устойчивая s2 и s2p6 кон-фигурация, поэтому атомы стремятся создать устойчивые 2-х или 8-и электронные оболочки.
ТЕОРИЯ КОССЕЛЯ
Застройка внешнего ē слоя до двух или восьмиэлектронной конфигурации может происходить двумя способами:
а) путем присоединения электронов б) путем отдачи электронов
а) 11Na 1s22s22p63s1
Na0 – ē → Na+[1s22s22p6(Ne)]
б) 17Cl 1s22s22p63s23p5
Cl0 +ē → Cl-[1s22s22p63s23p6(Ar)]
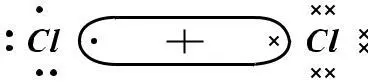
Процесс образования химической связи заключается в передаче электронов от атома Na к атому Cl, в результате чего образуются разноименно заряженные ионы, связанные между собой силами электростатического взаимодействия. Такая связь получила название ионной (гетерополярной) или электровалентной.
Недостаток теории в невозможности объяснения связи в органических соединениях, а также в молекулах H2, Cl2 и т.д.
ТЕОРИЯ ЛЬЮИСА
Основным положением теории Льюиса является то, что образование химической связи до устойчивой 2-х или 8-элект-ронной оболочки осуществляется путем обобществления электронов.
1) Cl2 17Cl 1S22S22P6 3S23P5
Символом элемента обозначим ядро атома с внутренними электронами, внешние валентные электроны – точками.
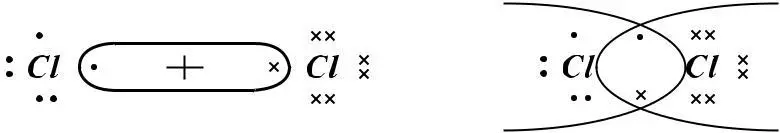
(Cl–Cl)
Рассмотрим образование химической связи для молекулы N2



7N 1S22S22P3
Читать дальшеИнтервал:
Закладка:










