Лев Николаев - Металлы в живых организмах
- Название:Металлы в живых организмах
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:1986
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Лев Николаев - Металлы в живых организмах краткое содержание
Металлы в живых организмах - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
Рис. 12. Строение ферредоксина: а — окисленная форма; б — восстановленная форма, S — обозначает серу остатка цистеина
После присоединения электрона может возникнуть структура, показанная на рисунке 12, б.
В процессах фотосинтеза принимают участие именно эти ферредоксины. Их присутствие в хлоропластах растений доказано.
Белки некоторых микроорганизмов содержат один атом железа на молекулу (рубредоксины). Они имеют молекулярную массу около 10000; ион железа в них находится в тетраэдрической координации и окружен четырьмя цистеиновыми остатками. Функция этих белков пока не известна.
В низших организмах и фотосинтезирующих бактериях были найдены белки, содержащие на молекулу четыре и восемь атомов железа. Их внутреннее строение до конца не изучено, но несомненно, что все они содержат цистеиновые остатки, связывающие железные кластеры с белковой частью молекулы, и все обеспечивают передачу электронов в самых разнообразных биохимических процессах — от фотосинтеза до фиксации атмосферного азота.
Из фотосинтезирующих бактерий был выделен ферредоксин типа Fe4S4, с молекулярной массой около 9600. Другой аналогичный белок, содержащийся в этих бактериях, имеет молекулярную массу 10100 и во всех отношениях близок к первому. Оба они — одноэлектронные восстановители. В окисленной форме белок парамагнитен (один неспаренный электрон), в восстановленной — диамагнитен.
Резервы железа
Красные кровяные шарики — эритроциты живут всего около двух месяцев, затем они разрушаются и заменяются новыми. В то же время железо, которое содержится в эритроцитах (в форме гемоглобина), практически не выводится из организма. Человек получает очень немного железа с пищей, поэтому создается впечатление, что железо совершает в организме какой-то круговорот. Следовательно, должно существовать депо — "склад", предназначенный для хранения соединений железа, уже использованных ранее для создания гемоглобина и теперь дожидающихся, когда они снова понадобятся.
Ферритин. Надо иметь в виду, что ионы железа(III) не безвредны — в свободном (т. е. гидратированном) состоянии они обладают токсическими свойствами. Железо в такой степени окисления сохраняется в организме лишь после предварительного обезвреживания.
В 1937 г. из селезенки лошади был получен железосодержащий белок, названный ферритином и оказавшийся тем самым веществом, которое и сохраняет ионы железа (III) в нетоксичной форме. Позже выяснилось, что ферритин встречается не только в органах животных, но и у растений и даже у грибов.
У человека приблизительно 1/4 всего железа, совершающего круговорот, находится в форме ферритина, т. е. в депо, а около 3/4 — в гемоглобине крови.
В ферритине соединения железа связаны с белком и не проявляют токсичности; освобождение железа из ферритина сопряжено с восстановлением иона Fe 3+до степени окисления +2. Молекулярная масса ферритинового белка равна 450000, а у некоторых видов достигает 900000, иначе говоря, очень велика; ферритин окрашен в красно-коричневый цвет и содержит до 4500 атомов железа на молекулу белка.
Ферритин представляет собой белковые частицы, внутри которых, закутанные в полипептидные цепи, находятся ядра, или мицеллы, состоящие из сложных комплексов гидроксида и фосфата железа. Предполагают, что их состав можно приблизительно выразить формулой: (FeO-OH) 8*(FeO-ОРО 3Н 2).
Состав белковой части ферритина в настоящее время известен. В этом белке много остатков глутаминовой кислоты, серина и лейцина, а также аспарагиновой кислоты. Как часто наблюдается у белков, молекула ферритина сложена из меньших по размеру субъединиц; формой она напоминает тутовую ягоду — 20 или 24 небольшие сферические частицы окружают центральное ядро, состоящее из соединений железа. Имеются данные, свидетельствующие о кристаллическом строении ядра; сам ферритин также можно получить в кристаллической форме.
Трансферрины. Ферритин не мог бы успешно выполнять свои функции, если бы не существовало специальных средств доставки ионов железа(III) к клеткам (называемым ретикулоцитами), в которых происходит образование гемоглобина. Дело в том, что при тех значениях кислотности, которые характерны для физиологических условий (рН около 7), ионы железа(III) существуют в виде гидроксида; растворимость его очень мала, и поэтому концентрация ионов железа(III) в растворе, находящемся в равновесии с гидроксидом, составляет ничтожно малую величину, порядка 10 -14моль/л. Из раствора такой концентрации очень трудно "вылавливать" ионы железа. В сыворотке крови, в яичном белке, в молоке, в желудочном соке и других жидкостях и тканях организма были найдены особые белки, отличающиеся способностью активно связывать железо в форме ионов Fe 3+. Эти белки получили общее название трансферринов ("переносчики железа"); некоторые ученые делят их на классы: лактоферрины (содержатся в молоке), кональбумин (из яичного белка), сывороточный трансферрин (из крови) и др. Их белковые составные части немного отличаются друг от друга (особенно по содержанию гистидина и аргинина). Молекулярные массы трансферринов лежат в пределах от 77100 до 82000. Эти белки не имеют субъединиц и представляют собой частицы, состоящие из одной полипептидной цепи.
Каждая молекула трансферрина связывает два иона железа(III), причем получается продукт красного цвета. Было доказано, что в реакции связывания принимает участие ион бикарбоната, а ионы железа вытесняют шесть ионов водорода на одну молекулу белка. Поэтому реакцию можно схематически представить так:
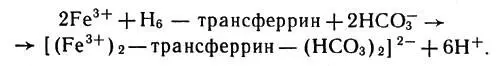
Каждая молекула трансферрина связывает два иона железа(III)
Предполагается, что ион бикарбоната увеличивает прочность связи между ионом железа и белком трансферрина. Самым замечательным свойством трансферрина является то, что этот белок "знает", по какому адресу надо доставить ионы железа. Каким-то образом трансферри-новые частицы отличают ретикулоциты от всех других клеток и отдают железо именно клеткам, производящим гемоглобин.
Сначала, по-видимому, трансферрин прочно связывается (адсорбируется) на поверхности ретикулоцита, затем связь между ними упрочняется, и железо переносится в клетку. Возможно, что повышение прочности связи и сопровождается внедрением трансферрина внутрь клетки. Прочность связи ретикулоцит — трансферрин зависит от содержания железа в последнем. Как только железо отдано, связь сразу ослабляется, и белок трансферрина выходит из клетки.
Почти полмиллиона молекул трансферрина может быть размещено на поверхности ретикулоцита. Что происходит дальше и как именно строится молекула гемоглобина в ретикулоцитах, пока еще не выяснено...
Читать дальшеИнтервал:
Закладка: