Лев Николаев - Металлы в живых организмах
- Название:Металлы в живых организмах
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:1986
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Лев Николаев - Металлы в живых организмах краткое содержание
Металлы в живых организмах - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
Сопоставляя особенности действия ферментов, участвующих в первых стадиях обработки пищевых веществ, с функциями последующих биохимических "блоков", нетрудно заметить, что наиболее специфичными по отношению к природе сырья являются начальные стадии. Углеводы подвергаются воздействию одних ферментных систем, жиры — других, а в результате из тех и других образуется ацетил-КоА. Очевидно, что коль скоро дело дошло до цикла Кребса, чувствительность к природе сырья снижается и проявляется только на перекрестках цикла и путей аминокислотного обмена. Еще менее специфично действие флавиновых и цитохромовых систем: откуда бы ни взялся водород, но если он попал к флавиновым дегидразам, они все равно отдадут его электроны в общий поток, текущий через систему переносчиков к кислороду.
Все рассмотренные выше процессы представляют собой реакции расщепления и последующего окисления. Энергия, выигранная при этом, накапливается в конечном счете в макроэргических связях аденозинтрифосфата (АТФ) или, более точно, в системе АТФ — вода (т. е. энергия, о которой идет речь, по величине равна энергии гидролиза АТФ).
Статьи расхода энергии в клетке и организме в целом весьма разнообразны. Энергия нужна для механической работы, связанной, например, с мышечной деятельностью, для поддержания надлежащего темпа выделения теплоты и, наконец, для многочисленных синтезов. Большое число молекул создается в живом организме, и притом так, что их образование требует затрат энергии. Затраты покрываются с помощью АТФ. Запас АТФ сам по себе невелик, но если организм располагает резервом в виде гликогена (углеводный биополимер), то в надлежащий момент гликоген переходит в глюкозу, затем глюкоза окисляется, и таким путем вновь возникает АТФ (см. гл. 8). Непосредственно к месту потребления энергия доставляется в форме макроэргических связей этого соединения.
Процессы, которые мы рассматривали до сих пор, состоят из последовательных реакций перестройки и синтеза молекул, причем источником энергии служат реакции, освобождающие скрытые запасы химической энергии. Так, энергия, заключенная в системе глюкоза — кислород, больше энергии системы углекислый газ — вода; первая система переходит во вторую в результате обмена веществ в организме. Именно благодаря разности в запасе энергии исходных и конечных веществ клетки осуществляют все операции, связанные с синтезом белков, мышечной деятельностью, поддержанием температуры на оптимальном уровне и другими процессами, идущими с затратой энергии.
Глава 7. Железо и медь в организмах; их роль в энергетике клетки
Эти два металла играют исключительно важную роль как в технической культуре человечества, так и в организме человека. Но в технике используют свободные металлы или их сплавы, а в организмах действуют ионы железа и меди.
Природа экономна. Создавая сложные комплексные соединения металлов, она приспособила их для выполнения различных биохимических "обязанностей". Одно и то же соединение железа способно выполнять различные виды работы, смотря по тому, с каким белком оно связано и в каком валентном состоянии находится ион металла. Поэтому железо, как и медь, необходимо и для нормальной деятельности ферментов, и для процесса кроветворения, и для переноса кислорода, и для организации движения электронов от одной молекулы к другой в процессе обмена веществ (метаболизма).
Железо
Как мы уже указывали, ионы железа чаще всего встречаются в форме комплексных соединений с протопорфирином:
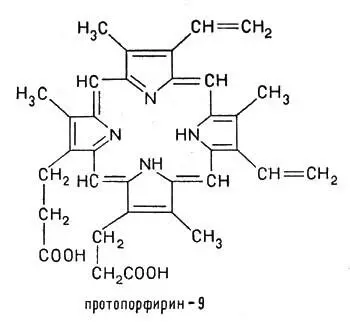
Ионы железа чаще всего встречаются в форме комплексных соединений с протопорфирином
Ионы железа в степени окисления +2, занимая внутреннюю область протопорфирина, замещают два атома водорода, которые находятся в группах NH, а два других атома азота соединяются с ионом железа за счет имеющихся у азота пар свободных электронов. При этом возникают сложные электронные орбитали, охватывающие все кольцо атомов С и N, окружающее центральный ион. Получившееся соединение — ферропротопорфирин — называется гемом. Это плоский цикл (макроцикл) с ионом железа(II) в центре. Гем входит в состав гемоглобина:
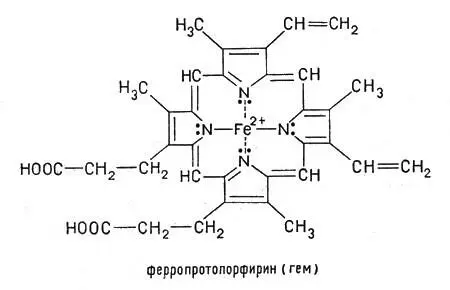
Ферропротопорфирин — называется гемом. Гем входит в состав гемоглобина
Подобная структура встречается часто, ее находят также в миоглобине и большинстве цитохромов, о которых речь будет ниже.
Гемоглобин — продукт присоединения гема к особому белку — глобину, с которым гем соединен прочно (рис. 8).
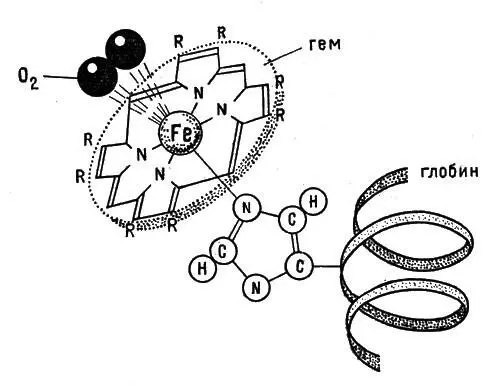
Рис. 8. Схема связывания кислорода гемоглобином
Клетки организма для своей жизнедеятельности нуждаются в кислороде. Того кислорода, который просто растворен в воде, а следовательно, может оказаться и в клеточных жидкостях, клетке не хватает. В 1 л воды при 20°С и нормальном давлении растворяется всего 6,6 см 3кислорода (что соответствует содержанию 3*10 -4моль кислорода в 1 л). Обмен веществ идет значительно быстрее, чем процессы проникновения кислорода воздуха в воду, и при такой его растворимости клетки организма просто задохнулись бы. Но кровь обладает особыми свойствами: в тех же условиях в 1 л крови человека растворяется 200 см3 кислорода! Это — результат связывания кислорода гемоглобином — пигментом крови, веществом ярко-красного цвета, содержащимся в красных кровяных шариках — эритроцитах.
Гемоглобин выполняет роль переносчика кислорода от легких к клеткам, причем степень окисления иона железа не изменяется при соединении всего комплекса с кислородом! Соединение это, называемое оксигемоглобином, непрочно: при повышенном давлении кислорода (в альвеолах легких) оно образуется, а там, где давление кислорода ниже (в дышащей клетке), распадается, освобождая кислород. Процесс следует схематическому уравнению:

Соединение это, называемое оксигемоглобином, непрочно: при повышенном давлении кислорода (в альвеолах легких) оно образуется, а там, где давление кислорода ниже (в дышащей клетке), распадается, освобождая кислород
Равновесие смещается в правую сторону в легких и в левую — в клетках. Окраска оксигемоглобина более яркая, поэтому венозная кровь, содержащая восстановленный (лишенный кислорода) гемоглобин, по сравнению с артериальной кажется темной. Каждый эритроцит несет в себе 280 млн. молекул гемоглобина. Молекулярная масса белка-глобина около 65000. Вот какое огромное сооружение тащит эритроцит для того, чтобы обеспечить своевременную доставку кислорода клеткам. На одну молекулу глобина приходится четыре атома железа, иначе говоря, четыре гема. Каждый гем окружен сложной белковой цепочкой, состоящей из остатков аминокислот: 574 аминокислоты израсходовала природа на создание этих цепочек. Всего цепочек четыре: две из них одинаковые и называются α-цепями, а две другие — тоже одинаковые, но отличные от первых, — β-цепями (рис. 9).
Читать дальшеИнтервал:
Закладка: