Александр Артеменко - Удивительный мир органической химии
- Название:Удивительный мир органической химии
- Автор:
- Жанр:
- Издательство:Дрофа
- Год:2005
- Город:Москва
- ISBN:5-7107-9540-2
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Александр Артеменко - Удивительный мир органической химии краткое содержание
Книга адресована старшеклассникам, учителям, а также тем, кто интересуется органической химией.
Удивительный мир органической химии - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
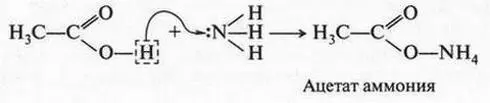
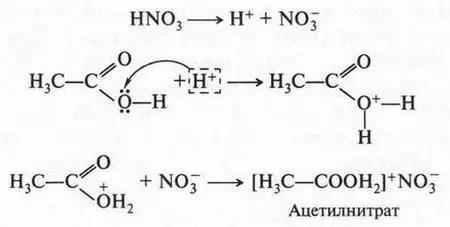
Можно теперь объяснить и вторую реакцию — взаимодействие азотной кислоты с уксусной кислотой. Азотная кислота, как более сильная, отдает протон, а уксусная кислота, как очень слабая (по сравнению с азотной), присоединяет его. Это присоединение идет за счет неподеленной пары электронов атома кислорода гидроксильной группы:
Эти примеры говорят о том, что кислоты и основания следует рассматривать в единстве, в неразрывной связи, а не противопоставлять их друг другу. Вещество может проявлять кислотные свойства лишь при взаимодействии с основанием, и, наоборот, основные свойства вещества можно обнаружить только в присутствии кислоты. Так, согласно теории С. Брёнстеда, одно и то же вещество в зависимости от условия реакции может обладать и кислотными, и основными свойствами:
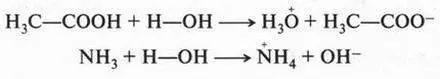
В первом случае вода проявляет свойства слабого основания (акцептор протонов), во втором — обладает слабыми кислотными свойствами (донор протонов).
Однако встречаются реакции, которые хотя и носят кислотно-основный характер, но ни одно из реагирующих веществ не является донором протонов. Примером может служить реакция окисления триметиламина.
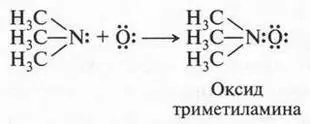
На первый взгляд трудно сказать, какое из этих веществ кислота, а какое — основание. Но это можно сделать, если принять во внимание еще одну теорию кислот и оснований, предложенную американским химиком Гильбертом Ньютоном Льюисом (1875-1946). Этот ученый предложил более широкое понятие кислоты и основания. Так, кислота, по утверждению Г. Льюиса, это соединение, неспособное к отщеплению протонов, но стремящееся использовать неподеленную пару электронов атома другой молекулы для образования химической связи. Отсюда следует и определение основания: это вещество, которое имеет неподеленную электронную пару и отдающую ее для образования этой связи. Другими словами, кислоты — акцепторы электронной пары, а основания — ее доноры. Снова рассмотрим реакцию окисления триметиламина. В этой реакции триметиламин выступает в роли донора электронной пары, а атом кислорода — в роли ее акцептора. Это означает, что триметиламин — основание, а атом кислорода — кислота.
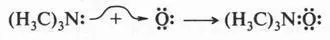
6.3. Муравьиная кислота и ее «родственники»
Вот теперь продолжим разговор о карбоновых кислотах — основных кислотах органической химии. Сразу же отметим, что карбоновых кислот много и все они разные. Мы же расскажем только о некоторых, наиболее известных и важных.
Наш рассказ начнем с муравьиной кислоты.
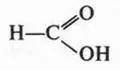
В молекуле этой кислоты карбоксильная группа связана не с радикалом, а с атомом водорода. Среди карбоновых кислот муравьиная кислота — самая сильная. Она почти в 10 раз сильнее всех остальных карбоновых кислот.
Муравьиная кислота содержится в некоторых растениях (крапиве, хвое и др.) и насекомых (в выделениях муравьев и пчел). Многие из вас не раз смогли убедиться в раздражающем действии муравьиной кислоты. При укусе лесного красного муравья вы испытали болезненное ощущение потому, что он впускает в ранку почти незаметное количество муравьиной кислоты. Кстати, само название — муравьиная — связано с муравьями, из которых эта кислота была впервые выделена. По той же причине жгутся листья крапивы, если их неосторожно задеть рукой.
Муравьиная кислота — бесцветная жидкость с резким запахом. Впервые ее получил Т. Пелуз в 1831 г. из синильной кислоты. Сейчас муравьиную кислоту получают пропусканием оксида углерода (II) через расплавленный гидроксид натрия:
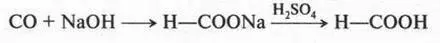
Как видите, вначале образуется соль кислоты (формиат натрия), а затем при действии на эту соль кислотой выделяют муравьиную кислоту в свободном виде.
Муравьиная кислота не только самая сильная в ряду одноосновных карбоновых кислот (одноосновных — значит с одной карбоксильной группой), но и наиболее активная. Действительно, если посмотреть на ее молекулу несколько иначе, то мы увидим... альдегидную группу.
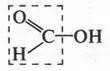
Поэтому муравьиная кислота проявляет не только кислотные свойства, но и восстанавливающие. Так, она восстанавливает серебро из оксида серебра:

Такая реакция называется реакцией «серебряного зеркала». Название возникло потому, что если реакцию проводить в пробирке, то на ее стенках можно увидеть налет серебра («зеркало»).
При нагревании до 160 °С муравьиная кислота разлагается:

Как и все карбоновые кислоты, эта кислота со спиртами (в присутствии серной кислоты) образует сложные эфиры, а со щелочами — соли.
Муравьиную кислоту используют в текстильной промышленности в качестве протравы при крашении тканей, в кожевенной — при дублении кож, в пищевой — для консервирования фруктов, а также в производстве некоторых полимеров. Кроме того, муравьиная кислота — хороший растворитель для многих полимеров (капрона, найлона, поливинилхлорида и др.). Не обходится без этой кислоты и медицина.
Если о муравьиной кислоте многие только слышали, то о другой кислоте — уксусной — знают все.
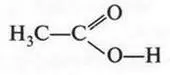
В формуле этой кислоты карбоксильная группа связана не с атомом водорода, а с радикалом (метильной группой).
Уксусная кислота известна человеку с незапамятных времен. Правда, в чистом виде ее выделили только в 1700 г., но еще до этого кислота часто использовалась в виде водного раствора. В 1845 г. ее получил синтетическим путем Г. Кольбе. Уксусная кислота образуется и «самопроизвольно» — при окислении спирта под влиянием особых бактерий (все слышали о скисании вина). В промышленности наиболее выгодным способом получения уксусной кислоты является прямое окисление бутана:
Читать дальшеИнтервал:
Закладка:









