Александр Артеменко - Удивительный мир органической химии
- Название:Удивительный мир органической химии
- Автор:
- Жанр:
- Издательство:Дрофа
- Год:2005
- Город:Москва
- ISBN:5-7107-9540-2
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Александр Артеменко - Удивительный мир органической химии краткое содержание
Книга адресована старшеклассникам, учителям, а также тем, кто интересуется органической химией.
Удивительный мир органической химии - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
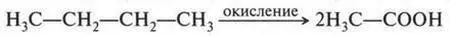
Уксусная кислота — бесцветная жидкость с резким кисловатым запахом. Если эта кислота не содержит воду, то при 16,6 °С она «замерзает» — образует бесцветные кристаллы. Такая кислота называется ледяной. В свое время ее изучал итальянский химик Костанцо Бонвичино (1739-1812). Водный раствор (70-80%) кислоты известен как уксусная эссенция , а 5-7%-й раствор называется столовым уксусом.
Уксусная кислота часто встречается в природе. Она содержится в некоторых растениях, моче, поте, желчи. Даже человеческий организм служит своеобразной «фабрикой» по выработке уксусной кислоты. За сутки с мочой выделяется 0,5 кг кислоты. Все продукты, содержащие углеводы, в процессе обмена веществ превращаются в кислоту.
Уксусная кислота — слабая кислота. Однако она изменяет цвет лакмуса в красный. От муравьиной кислоты она отличается не только меньшей «силой», но и отсутствием восстанавливающих свойств (она ведь не содержит альдегидной группы). Но «силу» кислоты можно повысить. С этой целью атом водорода в метильном радикале заменяют на атом хлора (или любого галогена). Полученная хлоруксусная кислота Сl—СН 2—СООН проявляет сильные кислотные свойства. Если же заменить все атомы водорода на атомы хлора, то трихлоруксусная кислота Сl 3С—СООН по силе не уступает некоторым минеральным кислотам.
Уксусная кислота служит для получения полимеров, красителей, сложных эфиров, ацетатного шелка, негорючей фото- и кинопленки ит. д. Находят применение и ее некоторые соли. Так, ацетаты железа, алюминия, хрома используют в качестве протравы при крашении тканей; ацетат свинца — для изготовления свинцовых белил, а ацетат меди (II) — для борьбы с вредителями сельского хозяйства.
Наряду с муравьиной и уксусной кислотами существуют и другие. В молекулах этих кислот содержатся радикалы, которые различаются длиной углеродной цепи. Так, масляная кислота в молекуле содержит три углеродных атома.
В свободном виде эта кислота обнаружена во многих растениях, грибах, а также в поте. Она входит даже в состав некоторых жиров, но не в больших количествах (например, в коровьем масле ее 3-4%). С неприятным запахом масляной кислоты связан специфический вкус и запах прогорклого масла.
Получают эту кислоту окислением бутилового спирта или сбраживанием отходов, содержащих крахмал (под действием особых микробов). Масляную кислоту часто используют для получения сложных эфиров, некоторые из которых применяют в пищевой промышленности (для придания фруктового запаха).
Существуют и другие кислоты, запах которых также никак нельзя отнести к приятным. Это капроновая (С 5Н 11—СООН), каприловая (С 7Н 15—СООН) и каприновая (С 9Н 19—СООН) кислоты. Название этих кислот имеет общий корень — «капр» (от лат. козел), названию соответствует запах. В виде триглицерида (т. е. сложных эфиров, образованных глицерином и карбоновыми кислотами) эти три кислоты входят в состав коровьего и козьего, а также кокосового масел. Однако необходимо отметить, что масляная, капроновая, каприловая и каприновая кислоты входят в состав немногих жиров. В этом случае они скорее исключение. Тогда возникает вопрос: какие же кислоты входят в состав других жиров? Оказалось, что при гидролизе большинства жиров образуются карбоновые кислоты с более длинными радикалами, в состав которых входит большое число углеродных атомов. Чаще такими кислотами являются пальмитиновая (С 15Н 31—СООН), стеариновая (С 17Н 35—СООН) и олеиновая (С 17Н 33—СООН) кислоты. Первая кислота так названа потому, что впервые была выделена из пальмового масла, название второй происходит от греческого слова «твердый», а название третьей связано со словом «жидкое». Кислоты, содержащие в радикале свыше десяти углеродных атомов, называют высшими кислотами. Вот эти кислоты и входят в виде триглицеридов в состав большинства жиров. Если омылить эти жиры, то можно обратно получить высшие карбоновые кислоты. Однако в настоящее время эти кислоты получают окислением высших алканов (парафинов). Так, из 1 т алканов можно получить около 600-700 кг кислот. Смесь твердых пальмитиновой и стеариновой кислот получила название стеарина. Этот продукт часто используют для изготовления стеариновых свечей.
Высшие карбоновые кислоты обладают теми же химическими свойствами, что и обычные кислоты. Они образуют соли, сложные эфиры и другие соединения. Растворяются в органических растворителях, но нерастворимы в воде. С водными растворами щелочей образуют соли, которые называются мылами :
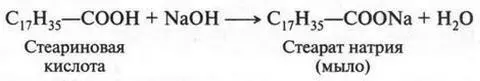
Натриевые и калиевые соли этих кислот (мыла) хорошо растворяются в воде (гидролизуются):

Таким образом, мыла — это соли высших карбоновых кислот. Обычное твердое (кусковое) мыло — это смесь натриевых солей пальмитиновой и стеариновой кислот.
О значении мыла знают все. С помощью мыла мы умываемся, купаемся. Мыло — страшный враг всех микробов. По годичному потреблению мыла судят о культуре нации. Еще не так давно мыло использовалось для стирки тканей. Мы и сейчас иногда применяем мыло для этих целей. Его называют хозяйственным. Почему же мыло удаляет загрязнения с рук, тканей и предметов? Дело в том, что оно обладает особым свойством — снижает поверхностное натяжение воды . Что это значит?
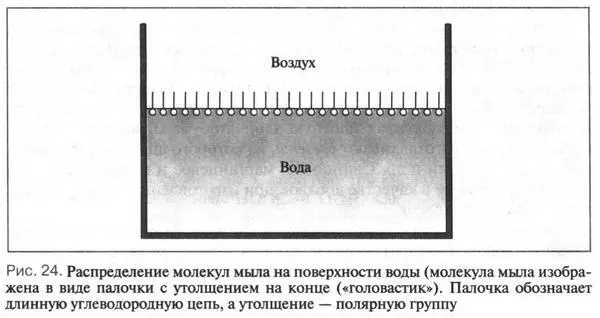
Молекулы мыла R—COONa (или К) состоят из двух частей: большого углеводородного радикала (С 12—С 18), обладающего водоотталкивающими свойствами, и полярной группы COONa (или К), растворимой в воде. Такую молекулу можно изобразить в виде палочки с утолщением на конце («головастик»). Палочка обозначает длинную углеводородную цепь, а утолщение на ее конце — полярную группу. При растворении мыла в воде его молекулы ориентируются таким образом, что нерастворимая часть молекулы выталкивается из воды, а растворимая погружается в нее (рис. 24). Такая ориентация молекул на границе воздух — вода приводит к снижению поверхностного натяжения воды{Поверхностное натяжение — свойство жидкости (например, воды) принимать форму с минимальной поверхностью.}. Это, в свою очередь, увеличивает смачивающую поверхность ткани или предмета. В результате — моющее действие увеличивается.
Следует сказать, что соли высших карбоновых кислот с числом углеродных атомов меньше десяти моющим действием не обладают, а с большим (свыше 20) трудно растворяются в воде. Поэтому оптимальное число углеродных атомов в высших карбоновых кислотах 12-18. Растворимость мыла в воде зависит также и от катиона: калиевое мыло («жидкое мыло») растворяется лучше, чем натриевое, а соли кальция, магния, бария и др. в воде нерастворимы. Поэтому моющая способность обычных мыл в жесткой воде, содержащей соли кальция и магния (например, морская вода), сильно падает. Это понятно, так как в такой воде ион натрия (или калия) замещается на кальций или магний. В результате образуются нерастворимые в воде кальциевые или магниевые мыла, которые выпадают в осадок в виде хлопьев:
Читать дальшеИнтервал:
Закладка:









