Алексей Сизенцов - Антибиотики и химиотерапевтические препараты
- Название:Антибиотики и химиотерапевтические препараты
- Автор:
- Жанр:
- Издательство:Литагент БИБКОМ
- Год:2012
- Город:Оренбург
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Алексей Сизенцов - Антибиотики и химиотерапевтические препараты краткое содержание
Антибиотики и химиотерапевтические препараты - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
Сравнивая эти величины, устанавливают, что испытуемый раствор, задерживающий развитие тест-организма в 10-й пробирке (разведение 1:1024), содержит 320 мкг/мл стрептомицина.
Расчет антибиотической активности испытуемого раствора при работе по методу последовательных разведений при наличии стандарта можно производить по следующей формуле
где Ри – максимальная степень разведения испытуемого раствора, при которой отсутствует рост тест-организма;
Рс – максимальная степень разведения стандартного раствора, обеспечивающая отсутствие роста тест-микроба;
С – исходная концентрация стандартного раствора антибиотика;
Х – искомая концентрация антибиотика в исследуемом растворе.
В нашем примере Ри=1024, Рс=32, С=10 мкг/мл; искомая концентрации антибиотика
X = 1024: 32 × 10 = 320 мкг/мл.
Метод последовательных разведений может дать сопоставимые результаты лишь при соблюдении определенных условий, а именно:
1) тщательная стерильность проведения анализов;
2) использование постоянных сред для разведения одного итого же антибиотика;
3) внесение определенного количества клеток или спор тест-организма;
4) определенная длительность инкубации пробирок, засеянных тесткультурой;
Иногда под действием испытуемого антибиотика возникают устойчивые к нему формы тест-микроба. Появление даже единичных резистентных клеток, которые могут дать затем развитие, приведет к ошибочным результатам при определении биологической активности препарата.
Чтобы избежать подобного явления для разведений используют не бульон, а агаризованные среды, разлитые в пробирки. После проведения процесса разведения пробирки размещают в наклонном положении, с тем, чтобы получить косячки застывшего агара. На поверхность скошенного агара микробиологической петлей высевают суспензию тест-микроба. После этого пробирки помещают в термостат на 24 ч при температуре, оптимальной для развития тесторганизма. Расчет активности ведут тем же способом, что и при разведении антибиотика (культуральной жидкости) в жидкой среде. Появление одиночных колоний, образовавшихся из резистентных форм, в расчет не принимается.
Определение антибиотической активности методом серийных разведений можно производить и на чашках Петри. В пробирки, содержащие по 9 мл расплавленного питательного агара, вносят по 1 мл определенного разведения изучаемого антибиотика или культуральной жидкости. После тщательного перемешивания содержимое пробирки выливают в чашку Петри и дают агару застыть. Затем по поверхности пластинки штрихами производят посев тесторганизмов. Чашки выдерживают в термостате при оптимальной для используемых тест-организмов температуре в течение времени от 20 до 21 ч.
Преимущество этого метода по сравнению с пробирочным методом разведений состоит в том, что в данном случае каждое разведение изучаемого препарата может быть использовано для многих тест-организмов.
3.8.1.2 Диффузионные методы
Количественное определение антибиотиков диффузионными методами основано на способности антибиотических веществ диффундировать в агаровых средах и образовывать зоны, в которых не развиваются используемые тесторганизмы.
Величина зоны диффузии антибиотика зависит, прежде всего, от химической природы антибиотического вещества и его концентрации, состава агаровой среды, ее рН, температуры и других факторов, которые необходимо учитывать при проведении анализа.
Антибиотики-полипептиды, обладающие большой и сложной молекулой, диффундируют гораздо медленнее, чем, например, антибиотики ациклического строения или антибиотики тетрациклиновой природы и гетероциклического строения. Поэтому для количественного определения антибиотиков, трудно диффундирующих в агаризованных средах, необходимо подбирать условия, обеспечивающие лучшую их диффузию. К таким условиям можно отнести добавление к среде отдельных веществ, повышающих диффузию антибиотиков. Так, СаСl 2способствует повышению диффузии грамицидина С. Иногда чашки с агаром, тест-культурой и антибиотиком помещают на 20-24 ч в холодильник (4 °C); тест-организм в это время не развивается, а антибиотик диффундирует. Используя этот метод, можно примерно в два раза увеличить скорость диффузии антибиотика при нормальном периоде роста тест-организма.
Концентрации испытуемых антибиотиков не должны быть слишком высокими, так как установлено, что диаметр зоны задержки роста тест-организма есть линейная функция логарифмов концентрации антибиотика, но лишь в определенных пределах концентрации. Так, увеличение концентрации неомицина выше 5 % по существу не сказывается на величине зоны задержки роста тестмикроба.
Величина зоны задержки роста тест-организма зависит в определенной степени от длительности контакта антибиотика со средой (таблица 7).
Таблица 7 – Величина зон угнетения роста Str.aureofaciens в зависимости от времени контакта антибиотика (на бумажном диске с агаром) (по Teillon, 1953)
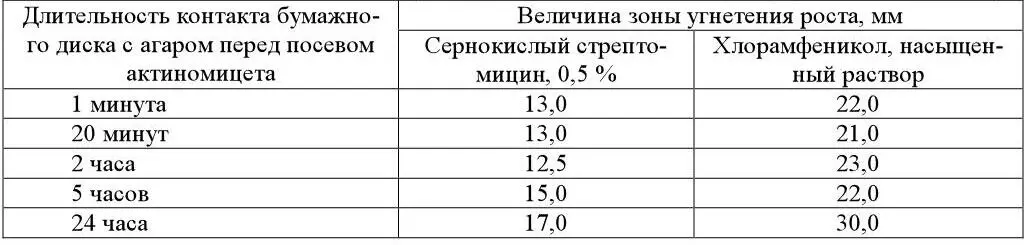
Анализы необходимо проводить через определенный интервал времени, так как между моментом посева тест-организма и началом его прорастания проходит какой-то промежуток времени, в течение которого антибиотик продолжает диффундировать в агар и оказывать биологическое действие.
Состав агаровой среды и ее рН также существенно влияют на величину образования зон задержки и рост тест-микроба. Стрептомицин, стрептотрицин, неомицин проявляют антибиотические свойства более сильно в щелочной среде (рН 7,5-8,0), тетрациклиновые антибиотики наиболее активны в слабокислой зоне (рН среды 6,3-6,4).
Наличие в среде ароматических аминокислот снимает биологическую активность антибиотика азасерина по отношению к Е.coli .
Плотность используемой культуры тест-организма должна быть постоянной для каждой серии опытов, ибо с повышением плотности клеток тесткультуры уменьшается величина зоны задержки ее роста, бактерии заметно влияют на процесс диффузии антибиотика ввиду того, что антибиотические вещества в определенной мере связываются этими организмами.
Применение в опытах постоянной плотности вегетативных микробных клеток и спор тест-организма в агаровой среде дает возможность получать зоны угнетения роста используемой тест-культуры соответствующей величины с резко очерченными краями.
Чаще всего для определения плотности микробных клеток и спор бактерий используют фотоэлектрокалориметр или стеклянный оптический стандарт, выпускаемый Государственным контрольным институтом им. Л.А. Тарасевича (ГКИ); стандарты соответствуют 5, 9, 10 и 11 единицам мутности. В качестве единицы мутности условно принята мутность взвеси тифозных бактерий, содержащая 100 млн. микробных тел в 1 мл. Однако при определении биологической активности антибиотиков в качестве тест-организмов чаще всего используют другие микробы, величина числового эквивалента мутности которых обычно не соответствует величине числового эквивалента мутности тифозных бактерий.
Читать дальшеИнтервал:
Закладка:










