БСЭ БСЭ - Большая Советская Энциклопедия (СУ)
- Название:Большая Советская Энциклопедия (СУ)
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
БСЭ БСЭ - Большая Советская Энциклопедия (СУ) краткое содержание
Большая Советская Энциклопедия (СУ) - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
С. п. воздействуют не только на микроорганизмы, но и на организм человека. Некоторые из них (например, бутамид) способны снижать уровень сахара в крови, в связи с чем нашли применение при лечении диабета сахарного. С. п. могут вызывать побочные явления: аллергические реакции, тошноту, рвоту, снижение содержания лейкоцитов в крови, невриты, нарушения функции почек и др. Применяются только по назначению врача.
Лит.: Закусов В. В., Фармакология, 2 изд., М., 1966; Машковский М. Д., Лекарственные средства, 7 изд., ч. 2, М., 1972.
В. В. Чурюканов.
Сульфаниловая кислота
Сульфани'ловая кислота', n- аминобензолсульфокислота, бесцветные кристаллы, разлагающиеся при 280—300 °С; ограниченно растворимы в воде (1 г в 100 г при 20 °С).
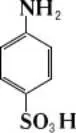
С. к. — внутренняя соль, в которой аминогруппа нейтрализована остатком сульфокислоты, поэтому С. к. не образует солей с минеральными кислотами, но её сульфогруппа может быть нейтрализована щелочами (например, с образованием натриевой соли H 2N—C 6H 4SO 3Na). Получают С. к. нагреванием анилинсульфата C 6H 5NH 2×  H 2SO 4при 180—200 °С. Диазотированием С. к. получают диазобензолсульфокислоту N + 2 — C 6H 4—SO - 3, широко используемую в производстве азокрасителей. Применение в медицине нашли амид С. к. H 2N—C 6H 4—SO 2NH 2(сульфаниламид), называемый белым стрептоцидом, и некоторые его производные (например, альбуцид, сульгин, сульфидин, сульфадимезин, сульфазол; см. Сульфаниламидные препараты ) . В лаборатории С. к. используют для определения нитритов и обнаружения некоторых металлов (осмия, рутения и др.).
H 2SO 4при 180—200 °С. Диазотированием С. к. получают диазобензолсульфокислоту N + 2 — C 6H 4—SO - 3, широко используемую в производстве азокрасителей. Применение в медицине нашли амид С. к. H 2N—C 6H 4—SO 2NH 2(сульфаниламид), называемый белым стрептоцидом, и некоторые его производные (например, альбуцид, сульгин, сульфидин, сульфадимезин, сульфазол; см. Сульфаниламидные препараты ) . В лаборатории С. к. используют для определения нитритов и обнаружения некоторых металлов (осмия, рутения и др.).
Сульфатазы
Сульфата'зы, сульфогидролазы, ферменты класса гидролаз; катализируют расщепление эфиров серной кислоты с выделением свободного сульфата. Широко представлены у животных, растений и микроорганизмов. Известны С., действующие на различные субстраты: арил-С. (гидролизуют ароматические эфиры серной кислоты); глико-С. (гидролизуют серные эфиры моно- и дисахаридов); хондро-С. (расщепляет хондроитин-серную кислоту ) ; стерол-С. (гидролизует серные эфиры стероидов ) ; целлюлозо-поли-С. (отщепляет сульфогруппы от полисульфатов целлюлозы). Наиболее изучены арилсульфатазы.
Сульфатная целлюлоза
Сульфа'тная целлюло'за, целлюлоза, получаемая по так называемому сульфатному способу варки. См. Целлюлоза .
Сульфатостойкий цемент
Сульфатосто'йкий цеме'нт,сульфатостойкий портландцемент, разновидность портландцемента. По сравнению с обычным портландцементом С. ц. обладает повышенной стойкостью к действию минерализованных вод, содержащих сульфаты , меньшим тепловыделением, замедленной интенсивностью твердения и высокой морозостойкостью. С. ц. получают тонким измельчением клинкера нормированного минералогического состава. Предназначается для изготовления бетонных и железобетонных конструкций гидротехнических и др. сооружений, испытывающих воздействие агрессивной сульфатной среды (например, морской воды), особенно в условиях переменного увлажнения, чередующихся замерзания и оттаивания. См. также Цемент .
Сульфаты
Сульфа'ты(от лат. sulphur, sulfur — сера), сернокислые соли, соли серной кислоты H 2SO 4. Имеются два ряда С.— средние (нормальные) общей формулы Mg 2SO 4и кислые ( гидросульфаты ) — MHSO 4, где М — одновалентный металл.
С. — кристаллические вещества, бесцветные (если катион бесцветен), в большинстве случаев хорошо растворимые в воде. Малорастворимые С. встречаются в виде минералов: гипса CaSO 4×2H 2O, целестина SrSO 4, англезита PbSO 4и др. (см. Сульфаты природные ) . Практически нерастворимы барит BaSO 4и RaSO 4. Кислые С. выделены в твёрдом состоянии лишь для наиболее активных металлов — Na, К и др. Они хорошо растворимы в воде, легко плавятся. Нормальные С. можно получить растворением металлов в H 2SO 4, действием H 2SO 4на окиси, гидроокиси, карбонаты металлов и др. Гидросульфаты получают нагреванием нормальных С. с концентрированной H 2SO 4:
K 2SO 4+ H 2SO 4= 2KHSO 4.
Кристаллогидраты С. некоторых тяжёлых металлов называются купоросами.
Широкое применение во многих отраслях промышленности находят сульфаты природные. Подробнее о С. и их применении см. Алюминия сульфат, Аммония сульфат, Бария сульфат, Железа сульфаты, Кальция сульфат, Меди сульфат, Натрия сульфат.
И. К. Малина.
Сульфаты природные
Сульфа'ты приро'дные, класс минералов, представляющих собой природные соли серной кислоты. Содержит около 150 минеральных видов; однако число устойчивых и широко распространённых С. п. в земной коре сравнительно невелико ( ангидрит, барит, гипс, целестин, алунит, мирабилит, квасцы и др.). Химически С. п. представляют собой или простые безводные соли, либо большей частью простые или двойные соли с кристаллизационной водой или с добавочными анионами. Обобщённые формулы для последних имеют вид: A m[SO 4] pZ q × xH 2O и A mB n[SO 4] pZ qx x H 20, где А и В — катионы, а Z — добавочные анионы ([ОН] -, Cl -, [СОз] 2 -и др.). Важнейшие видообразующие катионы в С. п.: Fe (особенно Fe 3 +), Na +, К +, Cu 2+, Mg 2+, Al 3+, Ca 2+, Pb 2+, Ва 2 +. Основная кристаллохимическая структурная единица С. п. — тетраэдр [SO 4], в котором сера находится в центре. Анионы [SO 4] 2 -всегда отделены др. катионами и анионами, поэтому среди С. п. резко доминируют островные структуры. Возникновение цепных или слоистых структур обусловлено либо наличием водородных или гидроксильных связей, либо сочетанием их с прочными комплексами (UO 6и др.). Большинство С. н. обладает низкой симметрией (ромбические, моноклинные, реже триклинные). Кристаллы С. п., как правило, имеют изометрический габитус. Цвет С. п. обусловлен ионами-хромофорами, минеральными включениями и наличием дефектов. Плотность С. п. от 1490 до 6920 кг/м 3 . Для С. п. характерны низкая твёрдость (2—3,5 по минералогической шкале), повышенная растворимость в воде (особенно С. п. с одновалентными катионами).
Почти все С. п. образуются в зоне гипергенеза и при седиментогенезе в крупных водных бассейнах. В гидротермальных месторождениях С. п. представлены баритом, реже встречаются другие безводные сульфаты — ангидрит, целестин и англезит. Многие С. п. (например, гипс, брошантит, ярозит, купоросы и др.) образуются в зоне окисления сульфидных месторождений, при сольфатарной деятельности вулканов (например, алунит); некоторые редкие С. п. (например, халькокианит) возникают в результате фумарольной деятельности.
Читать дальшеИнтервал:
Закладка:
