БСЭ БСЭ - Большая Советская Энциклопедия (СУ)
- Название:Большая Советская Энциклопедия (СУ)
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
БСЭ БСЭ - Большая Советская Энциклопедия (СУ) краткое содержание
Большая Советская Энциклопедия (СУ) - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
И. К. Малина.
Сульфиды органические
Сульфи'ды органи'ческие, сераорганические соединения общей формулы R—S n—R' (R и R' — одинаковые или разные углеводородные остатки алифатического или ароматического ряда; n 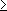 1 ) . С . о., у которых n = 1, называются моносульфидами, или тиоэфирами, с n = 2 и n > 2 — дисульфидами, трисульфидами и т. д.
1 ) . С . о., у которых n = 1, называются моносульфидами, или тиоэфирами, с n = 2 и n > 2 — дисульфидами, трисульфидами и т. д.
Моносульфиды кипят выше соответствующих эфиров простых ROR', сернистыми аналогами которых они являются [так, диметилсульфид (CH 3) 2S кипит при 38,0 °С, (СН з) 2О — при –23,6 °С]; окисляются, например, перекисью водорода до сульфоксидов, концентрированной азотной кислотой — до сульфонов, присоединяют галогены, алкилгалогениды, алкилсульфаты.
С. о. широко распространены в природе. Некоторые нефти содержат до 4—5% серы, большая часть которой связана в виде сульфидов; к С. о. принадлежат биологически важные природные продукты метионин, биотин и др.; диаллилдисульфид найден в чесноке. С. о. применяют как антиокислители и стабилизаторы моторных топлив и смазочных масел, как лекарственные препараты, красители (см. Сернистые красители ) , растворители. Некоторые синтетические ди- и полисульфиды имеют большое промышленное значение, например полисульфидные каучуки (тиоколы), тетраметилтиурамдисульфид, применяемый для вулканизации каучуков. Галогенированные С. о. токсичны (см., например, Иприт ) .
Сульфиды природные
Сульфи'ды приро'дные, класс минералов — сернистых соединений металлов. С. п. составляют около 0,15% (по массе) земной коры, насчитывают свыше 200 минеральных видов. К С. п. близки селениды природные, теллуриды природные, арсениды природные, а также антимониды, висмутиды. В качестве главных видообразующих элементов в С. п. находятся Pb, Cu, Sb, As, Ag, Bi, Fe, Co, Ni, входящие в состав многих десятков минеральных видов. Менее разнообразные соединения дают Zn, Cd, Mn, Ge, Sn, Tl, Mo, Hg (по 3—5), но среди них находятся такие распространённые и промышленно важные минералы, как сфалерит (ZnS), молибденит (MoS 2), киноварь (HgS). К элементам, встречающимся в виде изоморфных примесей в С. п., относятся Au, Ag, Ga, Ge, In, Tl, Re и др. Помимо простых С. п., производных H 2S (например, Ag 2S, PbS), выделяются персульфиды, производные H 2S 2(например, FeS2); сложные сульфиды (например, Pb 5Sb 4S 11) и сульфосоли с анионами [AsS] 3–, [SbS3] 3–и др. (например, Ag 3SbS 3); двойные сульфиды (например, халькопирит CuFeS 2). В современной классификации С. п., основанной на кристаллохимических данных, внутри главных химических типов различают подклассы с выделением среди них групп, соответствующих структурным типам. К важнейшим группам С. п. относятся: в подклассе координационных С. п. — группы галенита PbS, сфалерита ZnS, пирротина Fe 1–XS, пентландита (Fe, Ni) 9S 8, кубанита CuFe 2S 3, халькопирита, борнита Cu 5FeS 4и др.; в подклассе каркасных С. п. — группы аргентита Ag 2S, блёклых руд; в подклассе кольцевых С. п. — группа реальгара AsS; в подклассе островных С. п. — группы пирита FeS 2, кобальтина CoAsS — арсенопирита FeAsS и др.; в подклассе цепных С. п. — группы антимонита Sb 2S 3, миллерита NiS, киновари HgS и др.; в подклассе слоистых С. п. — группы молибденита MoS 2, аурипигмента As 2S 3, ковеллина CuS и др. По типу химической связи С. п. — преимущественно ковалентные соединения. Большинство С. п. — полупроводники (С. п. со структурами пирита, марказита, арсенопирита), но распространены и соединения с металлической проводимостью, а также изоляторы и сверхпроводники (некоторые дисульфиды). Ряд С. п. — сегнетоэлектрики (например, антимонит). По магнитным свойствам выделяются диамагнитные, парамагнитные, ферромагнитные, антиферромагнитные С. п. По оптическим свойствам большинство С. п. непрозрачны в видимой области, часто имеют высокую отражательную способность. Твёрдость по минералогической шкале обычно 2—4, у слоистых С. п. до 1—2 (молибденит, ковеллин и др.), у персульфидов до 5—7 (пирит и др.). Плотность свыше 4000 кг/м 3 . Преобладающая масса С. п. входит в состав сульфидных руд гидротермального происхождения; некоторые сульфиды Fe, Ni, Си, Pt связаны с магматогенными процессами в ультраосновных породах. С. п. могут иметь осадочное или экзогенное происхождение, отлагаясь из поверхностных растворов при действии H 2S (например, в угленосных толщах, в зонах окисления сульфидных месторождений). При окислении на поверхности Земли С. п. легко переходят в сульфаты, а затем в гидроокислы, карбонаты и др. соли кислородных кислот, реже — в самородные элементы (например, Cu, Ag). Многие С. п. являются важными рудными минералами.
Лит.: Рамдор П., Рудные минералы и их срастания, пер. с нем., М., 1962; Минералы. Справочник, т. 1, М., 1960; Марфунин А. С., Введение в физику минералов, М., 1974.
А. С. Марфунин.
Сульфирование
Сульфи'рование,замещение в органических соединениях водорода у атома углерода на сульфогруппу (—SO 3H) при действии серной кислоты или олеума. С. подвергаются главным образом ароматические соединения, например:
C 6H 6+ H 2SO4 ® C 6H 5SO зН + H 2O.
В алифатические соединения сульфогруппу вводят обычно косвенным способом, например обменом галогена в галогенопроизводных (1) или действием на углеводороды сернистого ангидрида и хлора при облучении ультрафиолетовым светом (сульфохлорирование) с последующим гидролизом (2):
CH 2= CH—CH 2CI + NaHSO 3® CH 2= CH—CH 2SO зН + NaCI (1)
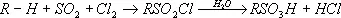 (2)
(2)
(R — углеводородный радикал, например, алкил).
С. соединений, неустойчивых к действию кислот, осуществляют комплексно связанным серным ангидридом, например диоксансульфотриоксидом:
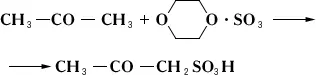
С. и сульфохлорирование — важные промышленные процессы, широко используемые в производстве сульфокислот, ионообменных смол и др. (см. также Сераорганические соединения ) .
Б. Л. Дяткин.
Сульфитация
Сульфита'цияв пищевой промышленности, консервирование плодов и овощей с помощью сернистого ангидрида SO 2, сернистой кислоты H 2SO 3, а также гидросульфита (бисульфита) натрия NaHSO 3. Сульфиты в концентрациях 0,1—0,2% (по массе) в кислой среде уничтожают плесневые грибки и дрожжи, вызывающие порчу плодов и овощей. Обработка выполняется сухим способом (окуривание сернистым газом в деревянных или каменных камерах) или мокрым (плоды или ягоды заливают в бочках слабым раствором кислоты или гидросульфита).
Читать дальшеИнтервал:
Закладка:
